药事日报303期 | 君实生物终止与阿斯利康约定的这项合作;多家企业高层变动!
时间:2022/01/05来源:医药之梯阅读:479
诗迈·药事日报 | NO.303期 |
欢迎来到本期药事日报
及时医药界资讯一手掌握!!!
|本期内容速览|
● 君实生物终止与阿斯利康约定的这项合作!
● 云顶新耀“戈沙妥珠单抗”新药上市申请在中国台湾获得受理
● 曙方医药获得罕见病新药Vamorolone大中华区独家权益
● 艾博生物任命袁纪军博士为公司肿瘤领域研发负责人 执行副总裁
● 总额8750万美元引进:信立泰恩那司他上市申请获受理
● 圣湘生物核酸检测分析仪获得美国FDA批准注册
● 艾伯维ADC疗法获FDA突破性疗法认定 治疗非小细胞肺癌
01
君实生物终止与阿斯利康约定的这项合作!
1月4日晚间,君实生物披露公告称,公司终止与阿斯利康推广合作,收回原协议约定的特瑞普利单抗注射液推广权。

据了解,2021年2月28日,君实生物与阿斯利康签署了《独家推广协议》,上市公司授予阿斯利康特瑞普利单抗注射液(商品名:拓益)在中国大陆地区后续获批上市的泌尿肿瘤领域适应症的独家推广权,以及所有获批适应症在非核心城市区域的独家推广权。
对于终止合作的原因,君实生物表示,随着公司自建的商业化团队逐步成熟,特瑞普利单抗注射液更多适应症成功纳入最新版国家医保目录,为更好地落实公司下一发展阶段的产品商业化推广策略,积极应对未来的市场竞争格局,公司与阿斯利康制药签署了《独家推广协议之终止协议》。
来源:君实生物
02
云顶新耀“戈沙妥珠单抗”新药上市,申请在中国台湾获得受理
近日,云顶新耀官微宣布,中国台湾食品药品监管部门已受理戈沙妥珠单抗(Sacituzumab Govitecan)的新药上市申请(NDA)。
据悉,该新药用于治疗成年病人无法切除的局部晚期或转移性三阴性乳腺癌(mTNBC),之前已接受过两次系统治疗,且其中至少一次用于转移性疾病。
该药物于2021年7月获得中国台湾食品药品监管部门的小儿或少数严重疾病药品优先**认定资格。
戈沙妥珠单抗的英文商品名为Trodelvy®,2020年4月获得了美国食品药品管理局的加速批准,并于2021年4月又进一步获得了完全批准并扩大了其先前获批的适应症,用于治疗接受过至少两种系统治疗(其中至少一种为针对转移性疾病的治疗)的不可切除的局部晚期或转移性三阴性乳腺癌成人患者。
2021年5月,中国国家药品监督管理局受理了戈沙妥珠单抗的生物制品上市许可申请(BLA),用于治疗接受过至少两种系统治疗(其中至少一种为针对转移性疾病的治疗)的不可切除的局部晚期或转移性三阴性乳腺癌成人患者,并被纳入优先审评品种。该申请目前正在审理中。
2021年11月,云顶新耀公布了戈沙妥珠单抗2b期EVER-132-001研究的关键结果,该研究以38.8%的客观缓解率(ORR)达到其主要终点。
这项研究在中国的80名患者中开展,所得结果与全球3期ASCENT研究显示的结果一致,且显示在中国人群中具有相似的疗效。
来源:云顶新耀
03
曙方医药获得罕见病新药Vamorolone大中华区独家权益
近日,中国罕见病新药研发与商业化创新型企业曙方医药与瑞士Santhera制药宣布就罕见病新药Vamorolone达成独家授权协议,曙方医药获得在大中华区开发和商业化Vamorolone用于杜氏肌营养不良(DMD)及其他罕见病适应症的独家权益。
协议总金额达1.24亿美元。根据协议,曙方医药将支付千万美元级别的首付款及美国注册申报相关里程碑款项,总计2000万美元。曙方医药还将支付两位数百分比的特许权使用费。
基于该协议,Santhera制药将授予曙方医药在大中华区(包括中国大陆、香港、澳门和中国台湾)开发和商业化Vamorolone用于治疗杜氏肌营养不良及所有其他潜在罕见疾病的独家权益。
Santhera制药将负责该产品的生产及供应,曙方医药将负责该产品的注册、开发及未来的商业化。曙方医药将视Vamorolone在美国的批准情况向中国监管部门提交该产品治疗DMD适应症的上市申请,预计该产品最早将于2024年进入中国市场。
由于庞大的患者基数和大量未满足需求,中国的医疗保健业务领域存在巨大机遇。近年来中国的医药监管改革使越来越多的创新药得以批准及上市。2018年杜氏肌营养不良被列入国家《第一批罕见病目录》中,该疾病领域存在着巨大临床需求。
据估计,中国目前约有7万名DMD患者,随着诊断率的提升,患病人数可能将不断增加。国内目前尚无获批的DMD治疗药物。曙方医药将积极与监管部门沟通,争取Vamorolone尽早在中国获批。
来源:曙方医药
04
艾博生物任命袁纪军博士为公司肿瘤领域研发负责人、执行副总裁
2022年1月4日,艾博生物宣布,任命袁纪军博士为公司肿瘤领域研发负责人,执行副总裁,负责领导公司肿瘤管线的研究工作。
来源:艾博生物
05
总额8750万美元引进信立泰恩那司他上市申请获受理
1月4日,CDE官网显示,信立泰提交了肾性贫血新药恩那司他片的上市申请并获承办。这是一款口服活性低氧诱导因子脯氨酰羟化酶***(HIF-PHI),有望成为罗沙司他之后第2款上市的同类药物。
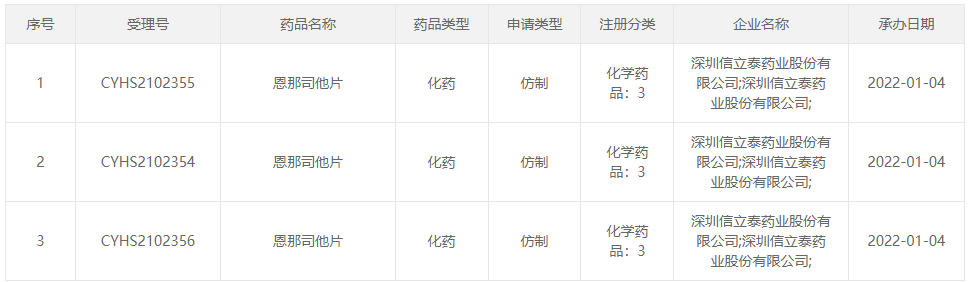
2019年12月26日,信立泰自日本烟草公司(JT)引进了恩那司他(原研发代号:JTZ-951),以2250万美元首付款+最高6500万美元研发注册里程碑付款+销售里程碑款和一定比例的销售分成获得了该药在中国市场肾性贫血领域的独家技术开发、生产、市场销售及商业化权益。2020年9月29日,该药在日本获批上市。
恩那司他是由JT研发的一款口服活性低氧诱导因子脯氨酰羟化酶***(HIF-PHI),适应症为肾性贫血。相较现有疗法,恩那司他片改善贫血机制明确,既可促进内源性促红细胞生成素的生成,也可改善铁的利用;且具有良好的安全性和有效性,可显著提高患者依从性。
肾性贫血是慢性肾脏病(CKD)患者中最常见的并发症之一,我国CKD患病率约占成年人群的10.8%(约1.2亿人),其中50%以上的患者合并贫血。目前,肾性贫血的标准治疗方法为促红细胞生成素(EPO)替代药物(如红细胞生成刺激剂等)联合静脉铁剂,皮**射给药治疗,但现有治疗方案存在治疗及达标率均低、患者依从性差等诸多局限。
此前,同类药物罗沙司他在美国曾因为临床数据更改事件引发质疑,最终遭到FDA拒绝批准。不过,修正后的新数据并没有改变以前对于透析和非透析患者使用罗沙司他的非劣效性结论,但其心脏安全性优势不复存在。各国对该药也是态度不一——罗沙司他全球首批在中国,日本、韩国和智利也批准了该药,在美国FDA拒批之后,欧盟仍然给出了肯定答复,批准了该药在欧洲上市。
来源:CDE官网
06
华熙生物李慧良辞去副总经理、首席技术官职务
1月4日晚间,华熙生物发布公告称,董事会于近日收到公司副总经理、首席技术官、核心技术人员李慧良先生的书面辞职报告,其因个人原因辞去公司副总经理、首席技术官职务,不再作为核心技术人员,辞职后其在公司及子公司将不再担任任何职务。

李慧良与华熙生物不存在涉及职务发明专利等知识产权权属纠纷或潜在纠纷的情形,其离职不影响公司专利等知识产权权属的完整性。
来源:华熙生物
07
圣湘生物核酸检测分析仪获得美国FDA批准注册
1月4日晚间,圣湘生物发布公告称,公司产品核酸检测分析仪(英文名称Portable Molecule Workstation)于近日获得美国FDA批准注册。

产品预期用途为:核酸检测分析仪(S-Q31B)与圣湘生物制造配套的检测试剂共同使用。基于聚合酶链式反应(PCR)技术,对来源于人体的核酸样本(DNA/RNA)进行临床提取、扩增、定量和定性检测分析。仅用于体外诊断用途;仅供专业使用。
该产品此前已获得国家药品监督管理局备案和欧盟CE认证,本次获得美国FDA批准注册后,可在美国销售。
来源:圣湘生物
08
艾伯维ADC疗法获FDA突破性疗法认定治疗非小细胞肺癌
2022年1月4日,艾伯维(AbbVie)宣布,美国FDA已授予在研抗体偶联药物(ADC)telisotuzumab vedotin(Teliso-V)突破性疗法认定(BTD),用于治疗在铂类药物治疗期间或治疗后发生疾病进展、c-Met过表达的晚期/转移性表皮生长因子受体(EGFR)野生型非鳞状非小细胞肺癌(NSCLC)患者。
据世界卫生组织(WHO)统计,在2020年,肺癌是全球癌症死亡的首因。全球新发肺癌病例超过200万,死于肺癌者约180万。
Teliso-V是艾伯维管线中研发进展最快的ADC项目。该药物靶向c-Met,以微管蛋白***MMAE作为毒性有效载荷。c-Met是一种在包括NSCLC在内的多种肿瘤中过度表达的受体酪氨酸激酶。目前,尚无获批用于治疗c-Met过表达NSCLC患者的抗癌疗法。
该BTD认定获得了一项正在进行的2期临床试验的支持。该试验旨在确定在二线或三线治疗背景中,最适合接受Teliso-V单药治疗的c-Met过表达NSCLC人群,然后进一步评估在选定人群中的疗效。试验主要终点是在≥12周随访中,患者根据中心审评的总缓解率(ORR)。
中期分析结果表明,在EGFR野生型非鳞状NSCLC患者中,c-Met高表达组的ORR为53.8%,c-Met表达水平中等组的ORR为25.0%。并且,Teliso-V联合表皮生长因子受体(EGFR)酪氨酸激酶***(TKI)奥希替尼(osimertinib,泰瑞沙),治疗经治c-Met过表达NSCLC患者的1期临床试验也正在进行中。未来,公司将在一项随机化3期临床试验中进一步评估Teliso-V单药治疗,在经治c-Met过表达NSCLC患者中的疗效。
来源:艾伯维
最新医药动态
更多»相关资讯
更多»- 1关于落实地高辛口服溶液等3个国家定点生产药品采购的通知
- 2药事日报321期 | 百济神州高层人事变动!华东医药布局医美行业!
- 3药事日报499期 | 礼来、辉瑞2022Q3发布!
- 4国家卫健委发文 影响所有中医药企
- 5精准医疗的技术基础—分子诊断技术发展现状
- 6药监局发文,一致性评价年末大限延期
- 7关于对12月份医疗机构上报药品短缺原因进行调查的通知
- 8国产首个!君实PD-1获FDA批准上市
- 9诺和诺德累积投资700亿持续扩充GLP-1产能
- 10抗癌新靶点—— SLC33A1
- 112015年度青海省公立医院藏成药挂网采购申报企业资质审核结果公示
- 12《赣州医疗机构“不满意就退费”工作实施方案(试行)》征求意见稿在网上引热议
- 13焦雅辉做客“健康中国人”透露2019年发展重点将是远程医疗
- 14药事日报335期 | 泽璟生物2021成绩单发布!多家药企人事变动一览
- 15药事日报436期 | 重磅!罗氏“不限癌种”疗法「恩曲替尼」在中国获批
 扫一扫关注医药之梯微信二维码
扫一扫关注医药之梯微信二维码
 个人登录
个人登录  企业登录
企业登录 
