药事日报328期 | 又一家药企准备上市!礼来达成17亿美元研发合作!

01
康乐卫士拟申请北交所上市
2月15日,康乐卫士发布公告称,公司拟向不特定合格投资者公开发行股票并在北证所上市。本次拟发行股票数量不超过4,453万股,不高于发行后总股本的25%,发行底价为77.68元/股。

资料显示,康乐卫士是一家从事新型疫苗研究、开发和产业化的创新驱动型生物制药企业,在新型重组疫苗研发方面具有国内外领先的核心技术与研发能力。
来源:康乐卫士
证监会同意海创药业科创板IPO注册
2月15日,根据《****共和国证券法》《****共和国公司法》《***办公厅关于贯彻实施修订后的证券法有关工作的通知》《关于在上海证券交易所设立科创板并试点注册制的实施意见》和《科创板首次公开发行股票注册管理办法(试行)》(证监会令第174号)等有关规定,中国证监会发布《关于同意海创药业股份有限公司首次公开发行股票注册的批复》,同意海创药业首次公开发行股票并在科创板上市的注册申请。
海创药业成立于2013年,此次IPO,公司拟募资25.04亿元用于研发生产基地建设、创新药研发项目和发展储备资金。
值得注意的是,同日(2月15日),证监会官网公布海创药业问询回复。此前,证监会就关于股份支付、关于HC-1119、关于行业政策影响、关于股份锁定等四方面进行问询。
对于上述问询,海创药业回复称,经核查,保荐机构及发行人律师认为:发行人在研发理念、研发立项、临床期研究、临床试验方案设计均与《指导原则》的精神、建议及要求相一致。《指导原则》等最新政策对发行人的主营业务不存在重大影响,发行人持续经营能力不存在重大不确定性。
来源:海创药业
治疗特定非小细胞肺癌,FDA接受Mirati公司KRAS***新药申请
Mirati Therapeutics公司今日宣布,美国FDA已经接受该公司为KRAS G12C***adagrasib递交的新药申请(NDA),用于治疗携带KRAS G12C突变的非小细胞肺癌(NSCLC)患者。他们至少接受过一种前期全身性疗法。该申请的PDUFA日为2022年12月14日。
新闻稿指出,FDA对adagrasib的审评将使用加速批准途径,这让FDA使用替代终点批准治疗严重疾病,并且满足未竟需求的创新药物。而且,这一申请将使用FDA的实时肿瘤学审评(RTOR)试点项目,它的目标是探索更为有效的审评流程,让安全和有效的药物尽早送到患者手中。
Adagrasib是一款具有高度特异性的强力口服KRAS G12C***,经过优化设计具有持久的靶点抑制能力。Adagrasib具有长达24小时的半衰期和广泛的组织分布,而且能够穿过血脑屏障,有助于最大限度地发挥药物效力。去年6月,美国FDA授予它突破性疗法认定,用于治疗携带KRAS G12C突变的经治非小细胞肺癌患者。在中国,再鼎医药拥有这款创新疗法在大中华区的开发权益,与Mirati联合递交的临床试验申请已于去年11月1日获得受理。
来源:药明康德
开发下一代ADC疗法,礼来达成17亿美元研发合作
mmunoGen公司今日宣布,与礼来(Eli Lilly and Company)达成一项全球性研发合作。授予礼来使用ImmunoGen公司的创新喜树碱(camptothecin)技术平台,针对礼来选择的靶点,进行抗体偶联药物(ADC)研发和商业化的独家权益。
喜树碱是一类以I型拓扑异构酶为靶点的重要抗癌药物。ImmunoGen专有的喜树碱和连接子设计旨在优化现有喜树碱技术,有潜力提供更宽的治疗窗口,并增强安全性和疗效。
根据协议,礼来将向ImmunoGen支付1300万美元的预付款,并选择初始靶标。礼来有权利选择更多靶标。ImmunoGen有资格获得高达17亿美元的潜在里程碑付款。礼来将负责与研发相关的所有费用。
来源:药明康德
康众医疗对外投资设立全资子公司
2月16日,康众医疗发布公告称,公司拟以自有资金不超过1500万美元设立全资子公司 COMPASS INNOVATION SINGAPORE PTE. LTD.(暂定名,具体以新加坡相关部门最终核准结果为准)。

该全资子公司设立后将被纳入公司合并报表范围内,公司合并报表范围将发生变更。
本次对外投资设立全资子公司CIS,其设立后将充分结合子公司(含参股公司)经营业发展状况、外部经营环境,适时逐步分批次调整优化公司海外子公司股权架构、即相关股权架构涉及的交易对价将基于调整进度分批分次支付,以确保资金的安全性,同时本次调整除新设CIS将导致合并报表范围变化外、其他调整不涉及合并报表范围变化;本次股权架构调整后的股权架构有助于进一步优化现有管理架构、提升管理效率,从而推动经营业务协同稳步发展。
来源:康众医疗
诺禾致源**董事史本军辞职

2月15日,诺禾致源发布公告称,史本军因个人原因于近日向公司董事会递交了辞职报告,申请辞去公司第二届董事会**董事职务及董事会下设专门委员会相应职务,辞职后不再担任公司任何职务,其辞职在新任**董事补选后生效。
来源:诺禾致源
奥赛康子公司ASKC202片获得临床试验批准通知书
2月15日,奥赛康药业发布公告称,其全资子公司江苏奥赛康药业于近日收到国家药品监督管理局下发的ASKC202片《药物临床试验批准通知书》,同意开展用于晚期实体瘤治疗的临床试验。

ASKC202片是具有自主知识产权的1类新药,是一种强效、高选择性的口服小分子c-MET***。多种癌症中出现MET基因改变或蛋白异常表达现象,包括非小细胞肺癌、胃癌、肝细胞癌等。MET通路异常激活引起MET基因扩增、蛋白过表达或基因突变,除了作为原发驱动致癌因素,MET过量激活与其它靶向疗法的耐药机制相关,其中最主要的为EGFR***的旁路耐药,5%-22%EGFR***耐药非小细胞肺癌患者出现MET基因扩增。靶向c-MET已成为肿瘤治疗领域的研发热点,国际上批准了两款高选择性MET***,分别是默克公司开发的tepotinib和诺华公司开发的capmatinib,目前国内仅有和记黄埔的沃利替尼片于2021年6月获批上市。子公司于2021年12月2日提交临床试验注册申请获得CDE受理,近日通过审评获得《药物临床试验批准通知书》。
ASKC202作为靶向c-MET的小分子***,已在一系列临床前肿瘤模型中证明了其活性,有望为c-MET通路异常肿瘤患者提供新的治疗选择。目前上市的高选择性MET***均用于治疗MET14外显子跳跃突变的非小细胞肺癌,尚没有药物获批用于EGFRTKI耐药c-MET扩增型肿瘤患者。ASKC202项目将与公司三代EGFR***ASK120067联合,用于一代EGFR***耐药的T790M阴性患者,以及用于三代EGFR***耐药的患者。
来源:奥赛康药业
四家药企产品被关闭采购状态!
2月15日,上海阳光医药采购网发布了关于关闭部分药品采购状态的通知。
通知内容中显示:根据《关于全面实施药品挂网公开议价采购的通知》(沪药事〔2018〕51号)及《关于进一步完善全面实施药品挂网公开议价采购有关事项的通知》(沪药事〔2019〕13号)要求,依医疗机构申请的药品自公布执行之日起180天内,提交申请的医疗机构需完成议价采购并确认验收,未完成的药品将无法在阳光平台继续采购。
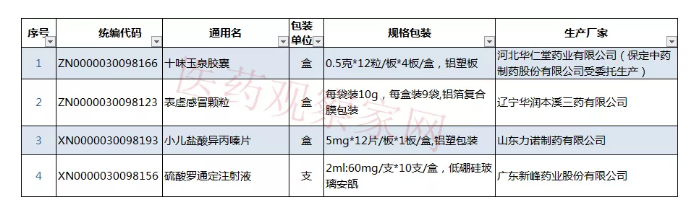
公示结束后,河北华仁堂药业有限公司(保定中药制药股份有限公司受委托生产)的十味玉泉胶囊,辽宁华润本溪三药有限公司的表虚感冒颗粒,山东力诺制药有限公司的小儿盐酸异丙嗪片,广东新峰药业股份有限公司的硫酸罗通定注射液仍未完成,无法在阳光平台继续采购。
对依医疗机构申请但未全部完成采购验收的药品,市药事所将于2022年2月17日起关闭采购状态。
来源:医药慧