药事日报369期 | 首仿!扬子江舒更葡糖钠获批上市;43家药企暂停采购!

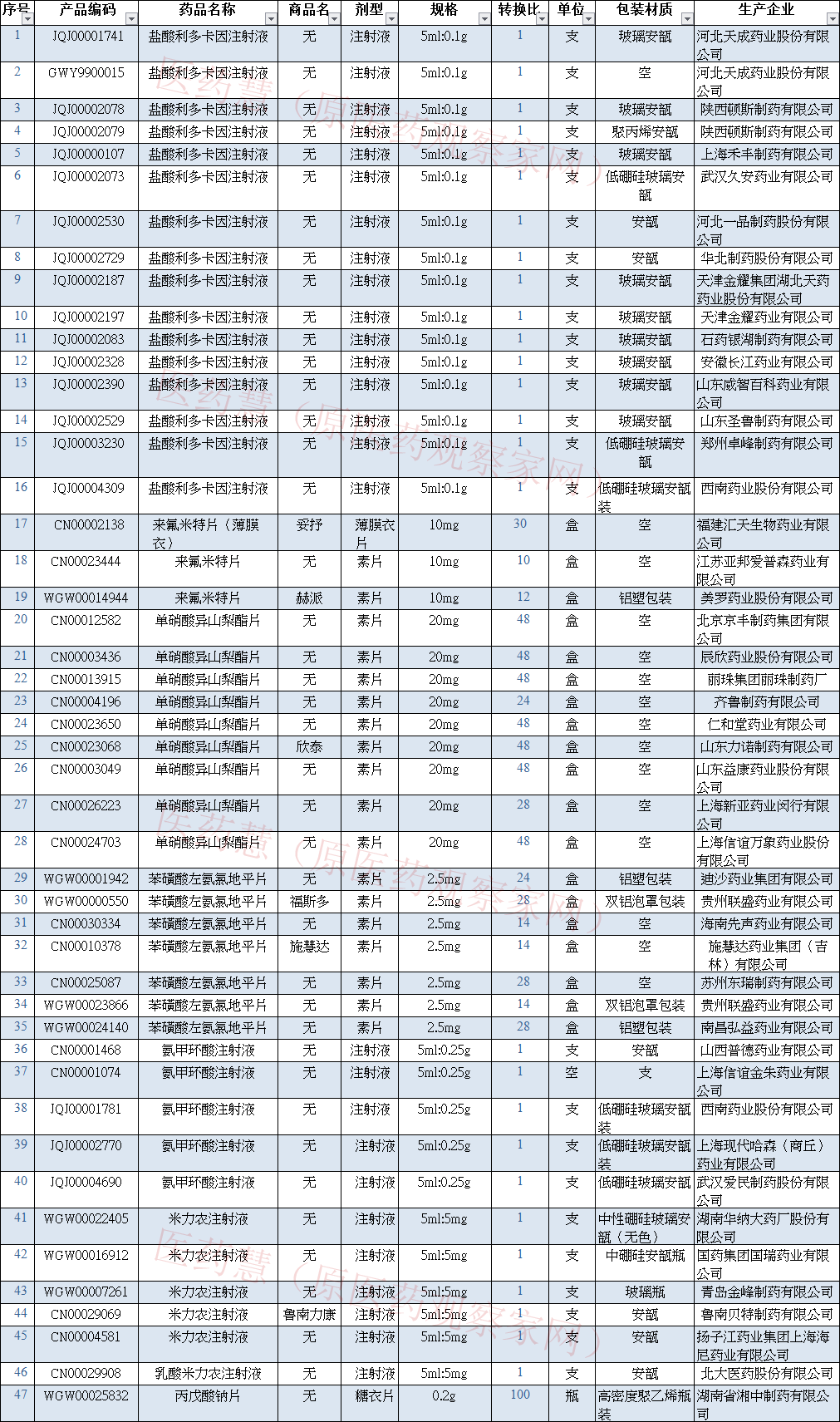
辉瑞JAK***托法替布片新适应症在中国获批 今日,中国国家药监局(NMPA)官网公示,辉瑞(Pfizer)申报的枸橼酸托法替布片新适应症上市申请已获得批准。公开资料显示,托法替布为一款JAK***,已经获美国FDA批准多个适应症。在中国,托法替布于2017年首次获批,目前该药正在针对至少17种疾病开展临床研究。目前尚未从公开信息中查询到此次获批的适应症。 JAK(Janus kinase)是细胞质酪氨酸激酶家族的一员,共有JAK1、JAK2、JAK3、TYK2四种亚型,它们在多种I型和II型细胞因子受体的信号级联中具有重要的作用。由JAK介导的信号通路包括JAK-STAT通路、MAPK通路和P13k-AKT通路等。其中,JAK-STAT通路与红细胞增多症、血小板增多症、白血病、骨髓纤维化等血液相关疾病,以及类风湿关节炎、强直脊柱炎、红斑狼疮、牛皮癣、白癜风等自身免疫疾病的发生息息相关。因此,JAK激酶家族成为治疗这些疾病的重要靶点。 托法替布(tofacitinib,英文商品名Xeljanz)是辉瑞公司开发的一款JAK***,它可以有效抑制JAK1和JAK3的活性,阻断多种炎性细胞因子的信号传导。在美国,托法替布于2012年首次被批准,目前已经获FDA批准多个适应症,包括强直性脊柱炎(AS)、类风湿性关节炎(RA)、银屑病关节炎、溃疡性结肠炎、多关节型幼年特发性关节炎。 (原文有删减) 来源:NMPA官网 默沙东21价肺炎疫苗获FDA突破性疗法认定 4月14日,默沙东宣布FDA授予其在研的21价肺炎疫苗V116突破性疗法资格,用于18岁及以上成人预防肺炎球菌感染以及细菌性肺炎。 V116对21种血清型肺炎球菌菌株都有免疫保护作用,包括 3,6A/C,7F,8,9N,10A,11A,12F,15A,15B/C,16F,17F,19A,20,22F,23A,23B,24F,31,33F,35B。一项两阶段、随机、双盲、阳性对照I/II期研究V116-001(NCT04168190)在未接种过肺炎疫苗的成人中评估了单剂注射V116的安全性、耐受性和免疫原性。第1阶段纳入18~49岁人群,第2阶段纳入50岁以上人群。 FDA在获知该研究的数据后做出了授予BTD的决定,详细结果将在6月份的国际肺炎链球菌和肺炎球菌性疾病研讨会上公布。V116的III期研究计划在今年内启动。 (原文有删减) 来源:NMPA 全球唯一在研IL-27单抗进入II期临床 4月14日,Surface Oncology宣布启动first in class单抗药物SRF388的两项II期临床试验。SRF388目前是全球唯一一款进入临床开发的IL-27靶向药物,也是第一个进入到II期概念验证阶段的IL-27单抗。 IL-27是异二聚体细胞因子,包括p28和EBI3两个亚基。其受体IL-27R在NK细胞和活化的T细胞上大量表达。另外在B细胞和未成熟T细胞中也有少量表达。SRF388能够阻断IL-27与其受体的结合,从而促进肿瘤微环境的免疫活化。 Surface Oncology曾在2016年跟诺华达成一系列协议,其中包括诺华享有SRF388的优先收购权的条款。不过2019年2月,诺华放弃了该项权利,Surface Oncology就保留了SRF388的全球权益。Surface Oncology公司目前市值仅有1.2亿美元。 (原文有删减) 来源:医药魔方 未过一致性评价,43家药企暂停采购! 4月14日,江苏省公共资源交易中心发布了一则关于暂停采购部分未通过仿制药质量和疗效一致性评价药品的通知。 通知内容中指出:根据《***办公厅关于开展仿制药质量和疗效一致性评价的意见》《江苏省医保局关于深入推进药品阳光采购的实施意见》等文件要求,同品种药品通过一致性评价的生产企业达3家以上的,将不再选用未通过一致性评价的仿制药。 现经过有关部门审核,发现有43家企业的产品未过一致性评价,现予以暂停采购的处理,涉及的产品有:盐酸利多卡因注射液、来氟米特片(薄膜衣)、来氟米特片、单硝酸异山梨酯片、苯磺酸左氨氯地平片、氨甲环酸注射液、米力农注射液、乳酸米力农注射液、丙戊酸钠片;其中盐酸利多卡因注射液未过评的企业数量最多,共计14家;除此之外,单硝酸异山梨酯片也有9家企业未过评被依规暂停。 公示期为2022年4月14日至4月20日17:00,如有异议,企业需在公示期内通过省交易平台进行申诉,并提交相关材料,过期将直接暂停采购资格。完整名单如下: 来源:医药慧 周新华辞任嘉和生物执行董事、总裁职务 4月14日,嘉和生物发布公告称,因投放更多时间于其他事务上,周新华决定提呈辞任执行董事,自2022年4月15日起生效。周新华同时辞任集团总裁职位。 周新华,现任嘉和生物药业有限公司总裁,首席科学家。1990年获英国Belfast女王大学药学院博士学位,并在英国伯明翰大学生化系和美国Oklahoma大学化学系从事博士后研究。 据悉,周新华曾任全球最大生物制药公司Amgen工艺开发科学总监。由Amgen任用并受聘于北京大学担任IPEM项目长达10年的客座教授。由于他的在单克隆抗体光氧化变黄分子机制的发现和领导力,2007年获AMGEN 的科学工程进步奖。 来源:嘉和生物 步长制药转让四长制药1%股份,北京四环制药接盘 4月14日,步长制药转让四长制药1%股份,北京四环制药接盘。 股份转让前,四长制药由步长制药、北京四环制药分别持股50%、50%;股份转让后,步长制药持股49%、北京四环制药持股51%。此外,四长制药主要成员变更,刘君退出董事,刘鲁湘退出董事,新增王明耿为副董事长,齐艳坤为董事。 四长制药成立于2009年5月27日,法定代表人为郑建勇,注册资本为2830万元,经营范围包含小容量注射剂、大容量注射剂等。 北京四环制药成立于1995年12月26日,法定代表人为邓声菊,注册资本为2.5亿元,经营范围包含制造化学药品制剂、血液剂、原料药等。该公司由海南四环医药有限公司全资控股,后者由SUN MORAL INTERNATIONAL(HK)LIMITED全资控股。该公司有17家对外投资企业,包括深圳四环医药有限公司。 步长制药成立于2001年5月10日,法定代表人为赵涛,注册资本约11.42亿元,经营范围包括片剂、硬胶囊剂、颗粒剂等。该公司主要由步长(香港)控股有限公司持股43.01%,首诚国际(香港)有限公司持股7.25%。该公司有48家对外投资企业,持股100%的企业有20家。 来源:新浪医药新闻 恒瑞双喜临门!拿下暴涨200%的注射剂 再获ANDA文号 4月15日,NMPA官网显示,江苏恒瑞医药的中长链脂肪乳/氨基酸(16)/葡萄糖(16%)注射液获批(国药准字H20223219);同日,公司发布公告称,钆特酸葡胺注射液简略新药申请(即ANDA)已获得批准,意味着可以生产并在美国市场销售该产品。 中长链脂肪乳/氨基酸(16)/葡萄糖(16%)注射液是“全合一”肠外营养注射剂,用于当口服或肠内营养无法进行、不足或有禁忌时,为轻至中重度分解代谢的患者提供胃肠外营养治疗所需的能量、必需脂肪酸、氨基酸、电解质和液体。 目前国内市场上除了有原研进口药外,早前科伦和海思科于2018年拿下了生产批文,随后也通过了一致性评价,本次恒瑞按新分类获批并视同过评,成为该产品国产第三家企业。 据悉,钆特酸葡胺注射液是基于钆的静脉注射造影剂,用于成人和儿童(包括新生儿)大脑(颅内)、脊柱和相关组织的核磁共振成像,以检查血脑屏障损伤和血管异常。2021上半年在中国公立医疗机构终端造影剂TOP20品牌中,恒瑞的钆特酸葡胺注射液排名第十二位。 来源:米内网 首仿!扬子江舒更葡糖钠获批上市 4月15日,国家药监局批准舒更葡糖钠仿制药上市申请,意味着这款15亿美元重磅产品终于在国内迎来首仿。 舒更葡糖钠是全球首个上市的用于逆转神经肌肉阻滞剂的选择性肌肉松弛拮抗剂,在临床手术麻醉中可帮助全身麻醉患者精准、快速地逆转深度和中度肌肉松弛状态,促进患者恢复自主呼吸和肢体活动能力,帮助改善患者的术后转归。舒更葡糖钠发挥此作用在于其γ-环糊精的分子结构,可以与罗库溴铵形成复合物,降低血液中游离的药物浓度,从而逆转罗库溴铵的神经肌肉阻滞作用。 舒更葡糖钠由默沙东开发,2008年9月在欧盟上市(商品名:Bridion),2015年12月在美国上市,2017年4月通过优先审评程序在中国上市(商品名:布瑞亭)。根据财报,其2021年全球销售额高达15.32亿美元。 (原文有删减) 来源:医药魔方Info