药事日报505期 | 超112亿欧元!拜耳2022Q3销售额增长!辉瑞口服斑秃疗法上市申请拟纳入优先审评!

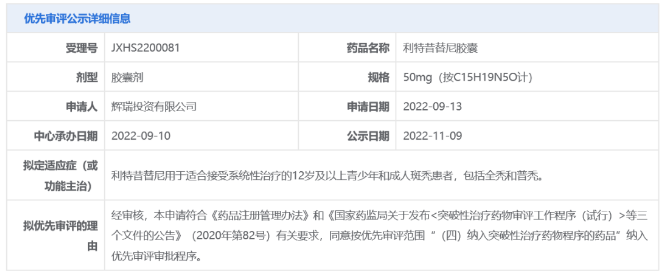
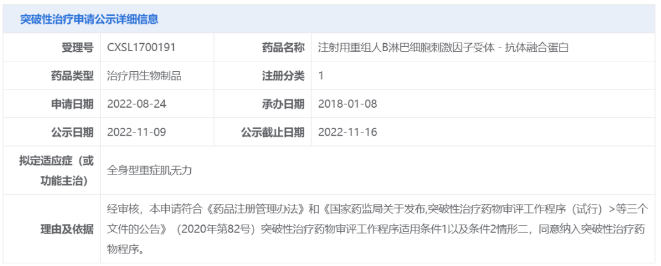
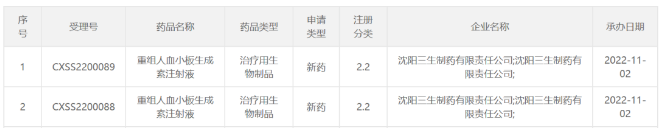
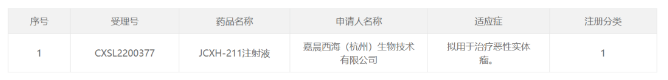
可恢复80%头发生长!辉瑞口服斑秃疗法上市申请拟纳入优先审评 11月9日,中国国家药监局药品审评中心(CDE)官网公示,辉瑞(Pfizer)申报的利特昔替尼胶囊新药上市申请拟纳入优先审评,拟开发适应症为:用于适合接受系统性治疗的12岁及以上青少年和成人斑秃患者,包括全秃和普秃。公开资料显示,利特昔替尼(ritlecitinib)是一款JAK3/TEC***,已在临床试验中表明可帮助患者恢复80%头发生长。 利特昔替尼是一种在研、一天一次的新型口服共价双激酶***,其对JAK3激酶以及在TEC家族中的酪氨酸激酶具高度选择性。该产品可借由抑制造成脱发的免疫细胞内信息通路来达到治疗斑秃的效果。此前,利特昔替尼于2018年9月获得美国FDA授予突破性疗法认定用以治疗斑秃。目前,该产品已在欧洲、美国、中国、英国、日本等国家和地区递交了新药上市申请。 来源:医药观澜 针对重症肌无力!荣昌生物1类新药拟纳入突破性治疗品种 11月9日,中国国家药监局药品审评中心(CDE)官网公示,荣昌生物1类新药注射用重组人B淋巴细胞刺激因子(BLyS)受体-抗体融合蛋白拟纳入突破性治疗品种,针对适应症为全身型重症肌无力。 重症肌无力是一种罕见的慢性自身免疫性疾病,已被纳入中国《第一批罕见病目录》。该病由针对突触后膜上乙酰胆碱受体、肌肉特异性激酶或其他乙酰胆碱受体相关蛋白的自身抗体引起,可不同程度影响眼球运动、吞咽、言语、活动和呼吸功能,约85%的患者会出现眼肌以外的症状,发展为全身型重症肌无力(gMG)。目前,治疗重症肌无力的主要治疗方法以胆碱酯酶***、糖皮质激素、免疫***为主,部分患者因药物疗效、耐受性或使用禁忌等问题无法充分有效地控制病情,临床存在大量未被满足的需求。 值得一提的是,就在近日(11月1日),荣昌生物宣布创新药泰它西普(研发代号:RC18)治疗全身型重症肌无力的中国2期临床研究已经完成。研究结果显示,泰它西普能显著改善患者病情且安全性良好。泰它西普还于今年10月获得美国FDA授予治疗重症肌无力的孤儿药资格。 来源:医药观澜 三生制药重组人血小板生成素儿童适应症申报上市 11月9日,三生制药宣布,公司向中国国家药品监督管理局(NMPA)提交的重组人血小板生成素注射液(特比澳)儿童ITP适应症上市申请已于日前获得受理,用于治疗儿童或青少年的持续性或慢性原发免疫性血小板减少症(ITP)。 ITP是一种获得性自身免疫性出血性疾病,其主要发病机制是血小板自身抗原免疫失调,导致体液和细胞免疫异常活化,共同介导血小板**加速及巨核细胞产生血小板不足。儿童ITP常表现为平时体健的儿童突发瘀点、瘀斑或出血,偶有患者因其他情况行全血细胞计数时发现血小板减少。目前,重组人血小板生成素注射液等促血小板生成药物已为中国ITP指南推荐首选的二线治疗药物。 特比澳正是由三生制药研发和生产的重组人血小板生成素注射液,已经在中国上市十余年,可用于治疗化疗引起的血小板减少症及治疗免疫性血小板减少症。既往研究证明,该产品在成人ITP患者中有良好的疗效和安全性。为满足儿童ITP患者的临床治疗需求,三生制药在中国共10家儿童医院及综合性医院启动开展了其儿童ITP适应症的3期临床研究。 来源:三生制药 百济神州:2024年起预计每年推动10款以上新的分子药物进入临床 2022年11月9日,百济神州公布了第三季度业绩报告。根据报告,该公司第三季度实现营业总收入26.59亿元,其中产品收入贡献了主要增长动能,同比增长92.2%,达23.93亿元。2022年前三季度,该公司累计产品收入达60.69亿元,同比增长114.6%。 百济神州联合创始人、董事长兼首席执行官欧雷强(John V. Oyler)先生表示:“百济神州第三季度产品收入取得强劲增长,主要得益于我们自主研发的基石产品百悦泽和百泽安销售额的提升。我们期待在未来几个月中不断带来重要里程碑进展,也期待保持强劲增长势头,为2022年画上**的句号。” 报告显示,百济神州核心抗癌产品BTK***百悦泽(泽布替尼)已拓展至全球58个市场,在全球范围内还有40多项药政申报正在审评中,有望在国际市场获得更多适应症的批准。 此前百济神州在投资者调研中表示,2024年起,公司预计每年将推动10款以上新的分子药物进入临床,涵盖靶点类药物以及肿瘤免疫类药物。 来源:药明康德 长效表达IL-12!嘉晨西海自复制mRNA药物获批临床 11月9日,嘉晨西海公司宣布,其开发的1类新药JCXH-211注射液已经获中国国家药监局药品审评中心(CDE)批准开展1期临床试验,拟开发治疗恶性实体瘤。根据嘉晨西海新闻稿,JCXH-211是一种基于自复制mRNA、编码人白细胞介素-12(hIL-12)的新型药物,它可在体内长效表达IL-12,潜在适用于多种实体瘤的治疗。 白细胞介素-12(IL-12)是一种天然存在的细胞因子,在机体对癌症的免疫反应中起着关键作用。公开资料显示,IL-12在多项临床前研究中始终显示出有效的抗肿瘤活性,然而在人体可耐受剂量下,重组IL-12蛋白无法显示应有的临床治疗效果。据嘉晨西海新闻稿介绍,IL-12疗法的关键挑战在于,其在人体内半衰期短以及高频率重复给药会带来潜在全身系统免疫毒性。而使用新的IL-12药物形式,如编码IL-12的自复制RNA(srRNA)有望解决IL-12在体内缓释、长效表达的难点,充分释放IL-12疗法的治疗潜力。 JCXH-211是嘉晨西海基于srRNA技术平台打造的一款编码人源IL-12的自复制RNA药物。数据显示,该药在小鼠模型中能有效杀伤肿瘤细胞,消除远端瘤,并预防肿瘤复发。据介绍,这种肿瘤清除效果来源于RNA复制子引发的强烈的抗**免疫反应,以及IL-12激活的强效抗肿瘤免疫反应。此外,该药还在临床前研究中展现出良好的安全性。JCXH-211已经于今年上半年在美国获批1期临床,并已经在美国得克萨斯大学MD安德森癌症中心完成首例患者给药。 来源:嘉晨西海 国内首个选择性PI3Kδ***!璎黎/恒瑞「林普利塞」获批上市 11月9日,国家药品监督管理局附条件批准上海璎黎药业有限公司的1类创新药林普利塞片(商品名:因他瑞)上市。该药为我国自主研发并拥有自主知识产权的创新药,适用于既往接受过至少两种系统性治疗的复发或难治滤泡性淋巴瘤成人患者。 林普利司是璎黎药业自主研发的1类创新药,2021年2月,恒瑞医药与璎黎药业签订战略合作协议,恒瑞医药将对璎黎药业进行2000万美金股权投资,璎黎药业授予恒瑞针对林普利司在大中华地区的联合开发权益以及排他性独家商业化权益。 来源:医药魔方 爱科百发RSV新药申报上市并拟优先审评 11月9日,CDE官网显示,爱科百发的齐瑞索韦肠溶胶囊的上市申请被纳入拟优先审评,适用于由呼吸道合胞**引起的2岁及以下儿童呼吸道感染的治疗。 齐瑞索韦(AK0529,又名爱司韦)是一种结构新颖的RSV融合蛋白小分子***,它与**的融合蛋白结合从而阻止**侵入人体细胞,防止感染引起的疾病。它也可以阻止**通过细胞与细胞间的融合, 从而实现抗**效果。 来源:CDE官网 拜耳集团2022年第三季度销售额增长5.7%达112.81亿欧元 拜耳集团三个事业部在第三季度均继续保持强劲业绩表现。拜耳集团本年第三季度销售额增长5.7%(经汇率与资产组合调整),达到112.81亿欧元,并得益于汇率变动带来的9.40亿欧元(2021年第三季度:6700万欧元)积极影响。不计特殊项目的息税折旧摊销前利润增长17.3%,达到24.51亿欧元。息税前利润达到11.99亿欧元(2021年第三季度:5.30亿欧元)。净收益达到5.46亿欧元(2021年第三季度:8500万欧元)。 处方药(处方药事业部)销售额增长了2.9%(经汇率与资产组合调整),达到49.55亿欧元。所有地区的业务均实现了增长,主要是在欧洲和中国市场的销量增长。该事业部的影像诊断业务在所有区域都实现了更高的销量。处方药事业部不计特殊项目的息税折旧摊销前利润增长15.2%,达到15.73亿欧元。盈利主要来自于销售的增长以及出售非核心业务的收入。 自我保健产品(健康消费品事业部)的销售额增长了4.4%(经汇率与资产组合调整),达到15.48亿欧元,标志着在上年同期超强增长的业绩表现下,所有地区的销售额继续保持强劲增长态势。健康消费品事业部不计特殊项目的息税折旧摊销前利润增长9.1%,达到3.36亿欧元。 来源:美通社