这款产品在美销售从超58亿美元到0业绩,一家中国药企的产品还在等待审批
/ 来源:医谷
新冠疫情三年,很多企业凭着相关新冠产品的先发优势“一发冲天”,但伴随着新冠感染人数的持续走低,曾经的大卖单品已经吃完了红利,甚至开始全线败退。
多款中和抗体疗法遭限制使用或撤销EUA
近日,再生元公布了2022年业绩,其全年总营收121.73亿美元,同比大幅下降24%,主要原因系其新冠中和抗体疗法REGEN-COV的销售额出现急剧萎缩,如若不计入该产品6.27亿美元(在美国之外其他市场的销售额)的销售业绩,则同比增长17%。
据了解,REGEN-COV由再生元和罗氏合作开发,2020年10月,因治愈感染新冠**的美国前总统***而“一炮走红”,***点名表扬了再生元,并且推动了REGEN-COV于同年11月获得FDA的紧急使用许可(EUA)。
自上市后,REGEN-COV销售一路走高,2021年全年,其在美国的全年销售业绩超58亿美元,全球销售业绩则高达75.74亿美元,这也直接推高了再生元2021年全年总收入达160.72亿美元,同比增长89%,80.8亿美元的利润更是接近于再生元2020年85亿美元的总营收。但据再生元业绩报,自2022年1月因对奥密克戎变异体疗效不佳被美国FDA限制使用以来,REGEN-COV在美国的销售业绩瞬间降至冰点,为0销售。去年4月,再生元宣布FDA延长了REGEN-COV用于治疗和预防新冠肺炎的上市申请**,PDUFA日期是2022年7月13日,但至今仍未有更多消息披露,业内估计,大概率是不批了。
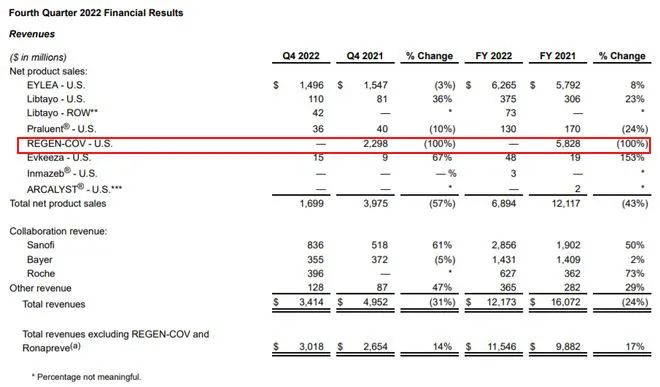
曾在新冠治疗市场占据重要市场份额的中和抗体疗法不香了吗?
事实上,除了再生元的REGEN-COV,全球范围内曾获得紧急使用授权或获批上市的中和抗体疗法还包括阿斯利康的Evusheld、葛兰素史克的Sotrovimab、礼来的bamlanivimab及bebtelovimab、礼来的bamlanivimab/etesevimab联合疗法、以及中国药企腾盛博药的安巴韦单抗/罗米司韦单抗联合疗法(仅在国内获批)。其中,阿斯利康的Evusheld是用于预防新冠,其余均用于治疗。
但除了腾盛博药的产品,其他几款产品已被美国FDA相继限制使用或者取消EUA。
最先被取消授权的是礼来的bamlanivimab,在其上市不足半年后,因应对新冠突变株疗效有限,FDA确定单独使用bamlanivimab的获益已小于已知和潜在风险,取消了对该疗法的认可。而bamlanivimab/etesevimab联合疗法也因同样的缘由被美国FDA于去年1月撤回了EUA。
2022年2月,美国FDA宣布会严格限制葛兰素史克Sotrovimab的紧急使用授权,原因系Sotrovimab对变种**的疗效欠佳,因此该疗法不应该用于某些变种**流行的地理区域。
2023年1月,阿斯利康宣布美国FDA已撤回Evusheld的EUA,该药曾于2021年12月在美国获得应急使用授权。数据显示,Evusheld对于新冠奥密克戎某些变种,例如对XBB、XBB.1.5、BQ.1和BQ.1.1等变异株可能无效,根据美国疾病控制和预防中心(CDC)的Nowcast模型数据,正是这些变种或导致美国90%以上的感染。
这家中国药企还在等待美国市场的“入场券”
在国内的新冠中和抗体治疗领域,腾盛博药毋庸置疑是领跑者。
2021年12月,腾盛博药的安巴韦单抗/罗米司韦单抗联合疗法获得国家药监局应急批准,用于治疗轻型和普通型,且伴有进展为重症(包括住院或死亡)高风险因素的成人和青少年(12-17岁,体重≥40kg)的新冠**感染患者,其中青少年适应症为附条件批准,成为了第一款获批的国产新冠中和抗体药物。截至目前,该产品仍然是唯一一款在国内获批的新冠中和抗体药物。
此外,腾盛博药之前宣布,安巴韦单抗/罗米司韦单抗联合疗法对BA·5变异株仍有效,并在规划该联合疗法在暴露前预防或暴露后预防的适应证。
在定价方面,腾盛博药曾宣布其在国内的定价基本控制在每人份一万元人民币以内,对于该定价,时任腾盛博药总裁的罗永庆曾表示参照药物定价的研发、生产成本及药物经济学评价等几个关键因素,安巴韦单抗/罗米司韦单抗联合疗法研发投入大(研发投入超2亿美元),在保证了效果的情况下剂量充足,再对比药物经济学价值,即用药后病人因缩短恢复时间、降低死亡率而产生的个人经济或社会价值上的获益,该价格是很合理的。而该产品在海外的商业模式是采取**采购的模式,比如在美国,是**采购几百万人份,每人份的定价大约在1500美元到2000美元。
2022年7月,腾盛博药宣布安巴韦单抗/罗米司韦单抗联合疗法正式在中国商业化上市,同月,根据甘肃省公共资源交易中心发布的挂网价,该疗法挂网单价为每支不高于全国最低价2417元,按疗程使用接近万元。市场可能认为这一售价高于预期,导致腾盛博药股价大跌。从2021年12月初至今,腾盛博药的股价从45港元/股一路跌至如今的不足10港元/股(今日收盘价为9.92港元),跌幅超75%。
另值得一提的是,云锋基金近期接连减持腾盛博药股份,累计套现超过8900万港元。截至目前,云锋基金对腾盛博药的持股比例从最早的超过7%降至4.69%。更早前的2022年11月,与云锋基金几乎同一时间、以近似持股成本价投资腾盛博药的红杉中国,也进行了股份减持。
截止目前,经医谷查询,也尚未有更多关于安巴韦单抗/罗米司韦单抗联合疗法商业化上市后的更多业绩消息披露,仅在去年年底的一份业务发展的最新情况公告中,腾盛博药提及安巴韦单抗/罗米司韦单抗联合疗法正在中国患者中使用,医生的早期反应良好。
另悉,腾盛博药宣布已向美国FDA提交了安巴韦单抗/罗米司韦单抗联合疗法的EUA申请,FDA除了要对临床试验的数据进行审核以外,还要对腾盛博药的受托生产企业进行核查,此前因为中国的疫情管控,FDA没能够来到中国进行现场核查,但伴随着国内疫情管控的放开,迄今为止,腾盛博药并未公告相关FDA现场核查信息进展,这或也意味着安巴韦单抗/罗米司韦单抗联合疗法在美国的获批仍然充满变数。
声明:“医药之梯”公众号本篇文章转载自其他文章,版权归原作者所有,文章目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本公众号留言联系,我们将在第一时间删除内容!衷心感谢!