近50条管线被终止!跨国药企业务精简
/ 01 /
近50条管线被终止研发
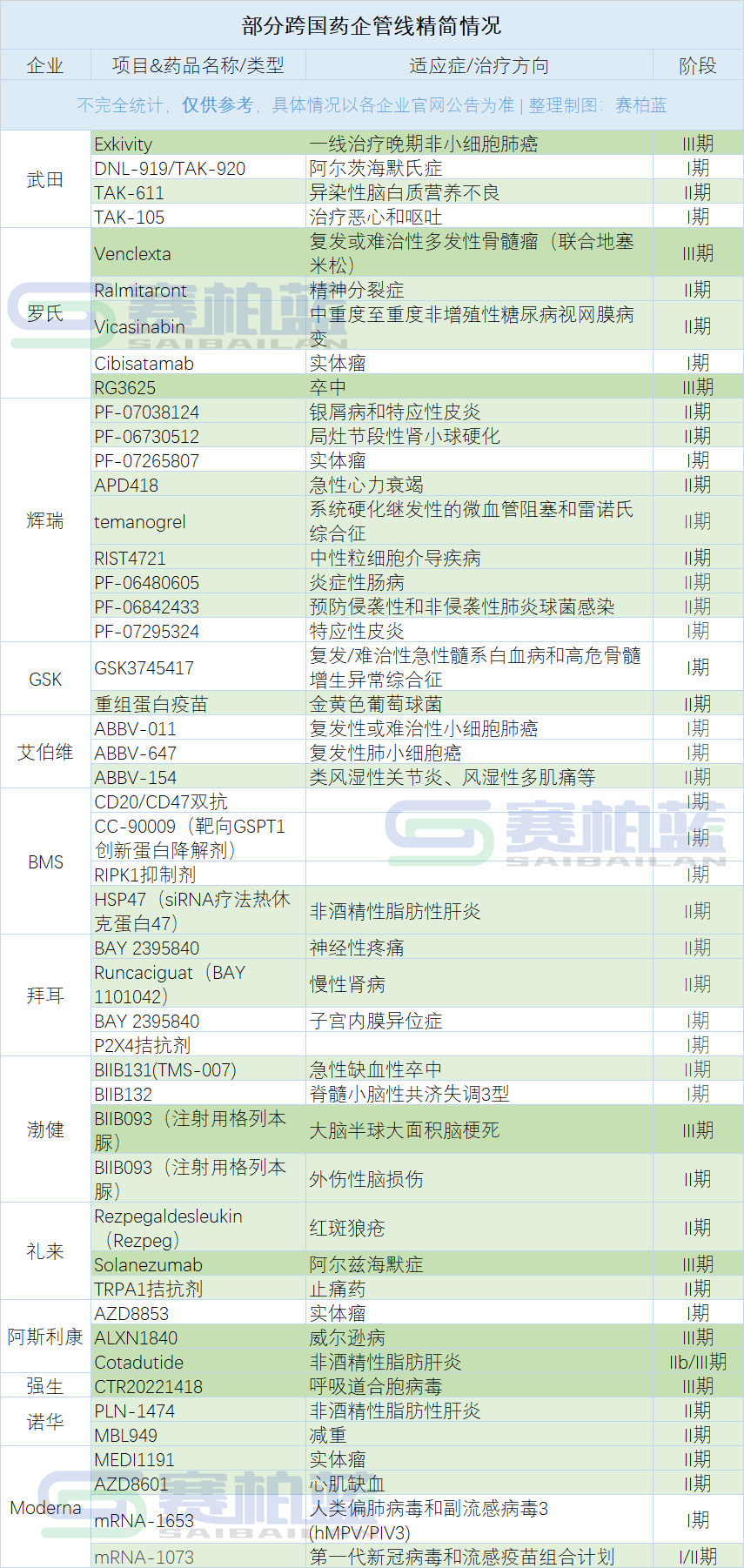
近日,武田在第三季度财报中披露,因一系列不可控因素,武田净亏损增长,全年净利润预测下调了71%,且公布了4条需被精简的管线,覆盖肺癌、阿尔茨海默氏症等疾病治疗领域,其中还涉及一款已上市产品。
就在上个月,武田经与FDA商议后宣布,将在美国启动琥珀酸莫博赛替尼(mobocertinib,商品名:安卫力/Exkivity)的主动退市。
据悉,莫博赛替尼获得FDA、国家药监局批准上市是基于其I/II期二线单臂试验,之后,武田并未延续二线应用,转而将研究瞄准一线治疗,启动了EXCLAIM-2,由于在III期临床中的确证性研究未达到主要终点,EXCLAIM-2被终止。
其主动撤回在美获批适应症的工作也随之展开,武田表示,莫博赛替尼在中国及其它已获批国家地区的后续计划也在与各地监管机构积极沟通中。
除了莫博赛替尼,武田与Denali合作开发的阿尔茨海默氏症候选药物DNL-919/TAK-920因在最高剂量下出现“中度、可逆的血液学效应”而被停止开发;另外,候选药物酶替代疗法TAK-611、治疗恶心和呕吐的候选药物TAK-105,也因未达到主要终点和次要终点、数据不支持等原因而停止进一步开发。
今年,十余家大型跨国药企公布了多起精简计划,近50条管线被削减(统计名单见文末)。
日前,罗氏第三季度财报等信息显示,其有四条产品研发管线将被精简,其中一项已进入III期研究、两项已进入II期、一项处于I期,覆盖多发性骨髓瘤、糖尿病视网膜病变、精神分裂症等疾病治疗领域。
具体包括因III期结果不及预期放弃Venclexta联合地塞米松治疗复发或难治性多发性骨髓瘤的研究;因无效性分析失败及未达到主要终点放弃TAAR1激动剂Ralmitaront治疗精神分裂症的II期项目;因未达到主要终点放弃Vicasinabin治疗糖尿病视网膜病变的II期项目;以及基于“全部疗效和安全性数据以及治疗领域不断变化的治疗格局”,放弃T细胞双特异性抗体Cibisatamab的实体瘤I期试验。
半年前,罗氏也先后停止了多项药物研发,包括天使综合征ASO药物Rugonerse,处于III期阶段的替奈普酶治疗卒中适应症,II期阶段血友病A基因疗法RG6358等。
/ 02 /
半数被终止管线止步II期
分临床阶段看,此次统计的48条被暂停管线中,II期项目最多(按更靠前进度统计,如IIb/III期计为III期,下同),占比约一半,达到24条。
以辉瑞为例,其有至少8个临床项目止步于此阶段,包括用于治疗银屑病和特应性皮炎的局部PDE4***PF-07038124、用于治疗急性心力衰竭的β3-adrenergic受体拮抗剂APD418,以及Temanogrel用于治疗系统硬化继发性的微血管阻塞和雷诺氏综合征的临床等。
II期试验也称为疗效试验或临床效能试验,主要目的是初步评价药物对目标适应症患者的治疗作用和安全性。
在这一阶段,受试者群体往往会在上一期试验的基础上扩大规模,随着受试者增加,药物的潜在安全性问题也更容易被发现;除了安全性,若药物在此阶段所表现的治疗效果与已有治疗方案相比没有显著优势,对应管线也很有可能被终止。
在此次统计中,I期项目出现频次居于II期之后,约有16条管线在此阶段前后被终止;在III期被终止的项目约8项。
分药物类型来看,小分子药物出现最为频繁。
以拜耳为例,其公布终止的4条管线均为小分子药物,包括用于神经性疼痛的BDKRB1受体拮抗剂BAY 2395840、用于慢性肾病的口服可溶性鸟甘酸环化酶 (sGC)激动剂Runcaciguat,以及用于**内膜异位症的BAY 2395840和一款P2X4拮抗剂。
近年来,医药行业热门赛道常出现“扎堆”的现象,部分领域甚至出现几十、上百家药企布局研发,但最终真正能够顺利上市、实现商业化的企业不会是多数。
随着市场环境变化,业务遍布全球的大型药企更需要对非核心产品管线进行终止、剥离,同时优化人员架构,以降本增效,实现新增长。