亘喜生物BCMA/CD19 CAR-T治疗RSLE的新药获批临床
12月21日,亘喜生物宣布中国国家药品监督管理局(NMPA)药品审评中心(CDE)正式批准了亘喜生物旗下FasTCAR-T自体CAR-T候选疗法GC012F用于治疗难治性系统性红斑狼疮(rSLE)的新药临床试验(IND)申请。

根据此项IND批件, 亘喜生物计划在中国启动一项1/2期临床试验,以进一步评估GC012F针对rSLE患者的安全性和耐受性。
此前,亘喜生物已于11月27日宣布将在美国开展针对同适应症的1/2期临床试验。
此外,一项针对rSLE患者的由研究者发起的临床试验(IIT)正在中国开展。
GC012F是一款基于亘喜生物专有的FasTCAR次日生产平台开发的B细胞成熟抗原(BCMA)和CD19双靶点自体CAR-T候选产品。
除了即将在中美启动的两项rSLE IND临床试验外,公司已在美国开展GC012F治疗复发/难治性多发性骨髓瘤(RRMM)的1b/2期IND临床试验;
此外,还有4项IIT临床试验正在评估该疗法针对rSLE、RRMM、新确诊的多发性骨髓瘤(NDMM)以及B-NHL的临床效果。
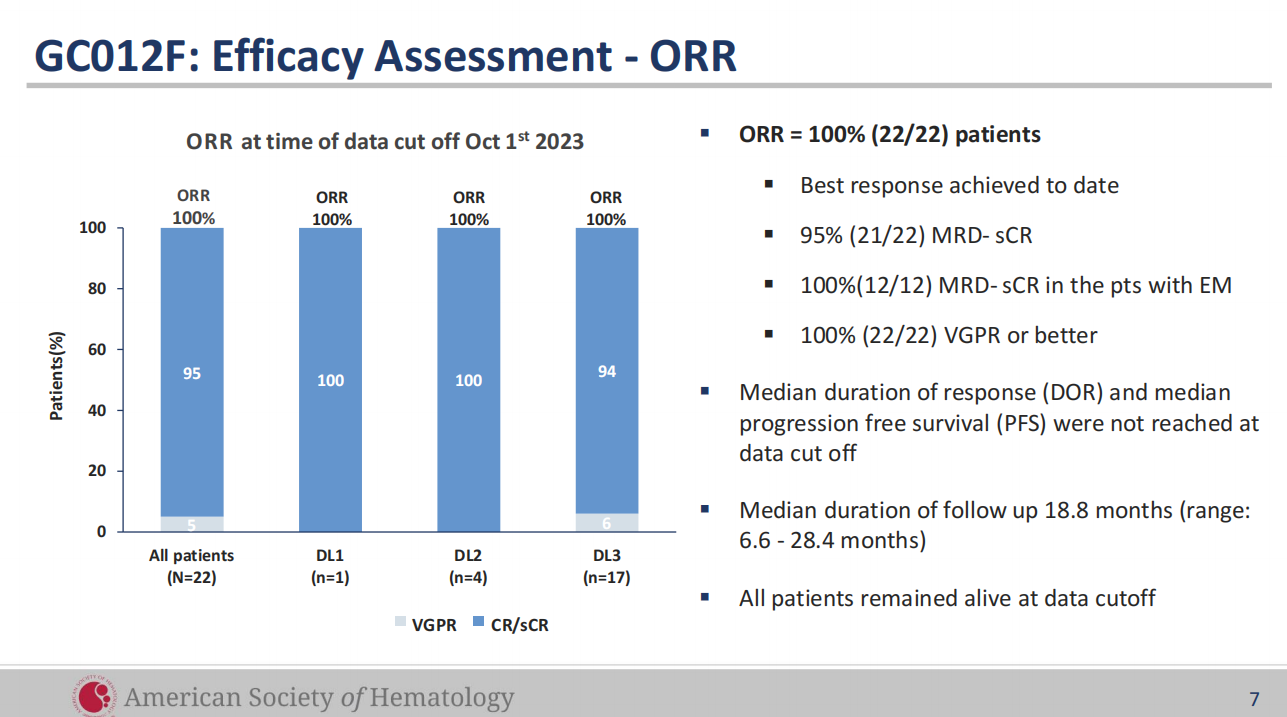
2023年11月,2023年ASH年会已公布GC012F治疗NDMM IIT临床试验的最新研究成果,该临床数据显示总体应答率(ORR)为100%,微小残留病灶阴性的严格完全缓解(MRD- sCR)率为95.5%。

亘喜生物包含多种自体和同种异体候选产品的丰富临床阶段产品管线,并有望与行业当前的CAR-T细胞疗法形成显著差异化。
