药事日报499期 | 礼来、辉瑞2022Q3发布!
时间:2022/11/02来源:医药之梯阅读:315

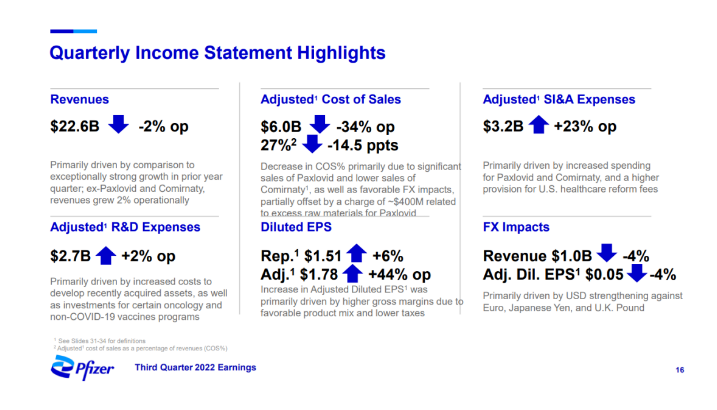
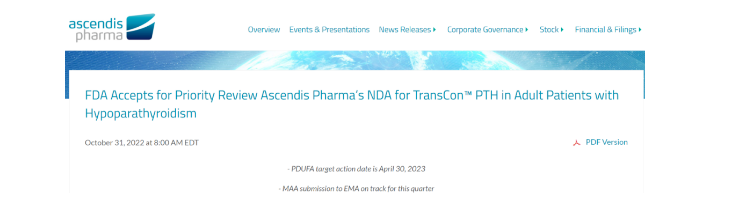
礼来重磅**tirzepatide上市4个月销售近2亿美元 11月1日,礼来发布了2022年Q3财报:全球收入为69.4亿美元,同比增长2%;净利润为14.52亿美元,同比增长31%;研发费用为18亿美元,同比增长6%。前三季度总营收为212.4亿美元,同比增长5%;净利润43.07亿美元,同比增长12%。 礼来本季度销售额的增长主要还是由Trulicity(度拉糖肽)、Taltz(依奇珠单抗)、Verzenio(阿贝西利)、Jardiance(恩格列净)等产品推动。 GIP/GLP-1受体双重激动剂Mounjaro(tirzepatide,替尔泊肽)获批上市不到半年,销售额已超2亿美元,第三季度在美国的收入达到9730万美元,在日本也获得了8600万美元收入,Q3约1.87亿美元。此外,该产品2型糖尿病适应症已在中国申报上市,肥胖适应症将在今年向FDA递交上市申请。随着适应症的不断渗透,Mounjaro收入将更加可观。 来源:医药魔方 辉瑞2022Q3:新冠疫苗收入下降65% 11月1日,辉瑞公布了2022年Q3财报,同时宣布其二价呼吸道合胞**(RSV)疫苗RSVpreF的III期临床取得阳性顶线结果。 2022年Q3辉瑞总收入为226亿美元,同比下降2%。 其中,新冠疫苗Comirnaty收入大幅下降65%,约为44亿美元;口服新冠药物Paxlovid的收入为75.14亿美元。 另外,RSV疫苗III期临床结果显示,从出生到90天,该疫苗对RSV引起的婴儿严重下呼吸道疾病(MA-LRTI)的效力达到81.8%,出生前六个月有效性为69.4%。同时,该疫苗耐受性良好,对母体接种者及其新生儿均无安全问题。辉瑞表示,将在年底前向FDA递交第一份监管申请。 来源:辉瑞 全球首款!甲状旁腺功能减退激素替代疗法获FDA优先审评,有望明年初上市 10月31日,Ascendis Pharma宣布,FDA已受理TransCon PTH用于治疗甲状旁腺功能减退成人患者的新药申请,并授予其优先**资格,PDUFA日期为2023年4月30日。如果获批,TransCon PTH将成为第一个治疗甲状旁腺功能减退的激素替代疗法。此前,TransCon PTH已被FDA和EMA授予治疗甲状旁腺功能减退的孤儿药资格。 TransCon PTH是一种每日一次的长效甲状旁腺激素(PTH)前药,它旨在每天24小时将PTH恢复至生理水平,以解决该疾病的短期症状和长期并发症。 来源:医药魔方 和誉医药新一代FGFR***在美获批临床 11月1日,和誉医药宣布,新一代FGFR***ABSK121的临床试验申请获得FDA批准,即将开展针对晚期实体瘤的国际首次I期临床试验。 成纤维细胞生长因子受体(FGFR)基因变异存在于多种类型的人类肿瘤中,主要通过FGFR基因扩增、突变、染色体易位以及配体依赖性活化等方式引起FGFR信号异常,促进肿瘤细胞增殖、存活、迁移和血管生成,最终导致恶性肿瘤的发展。 ABSK121为一款口服的、高活性、高选择性的新一代小分子FGFR***,可同时靶向野生型及突变型FGFR1-3。该药物在多个临床前模型中展现出与已获批FGFR***相当的强大抗肿瘤功效,并在FGFR耐药突变肿瘤模型中也展示出了优异药效,提示ABSK121可能为以第一代FGFR***进行初步治疗后复发或病情有所发展的患者带来临床益处。 来源:和誉医药 杜氏肌营养不良症新药DYNE-251获FDA快速通道资格 10月31日,Dyne Therapeutics宣布,FDA已授予其在研新药DYNE-251快速通道资格认定,用于治疗51号外显子跳跃突变的杜氏肌营养不良症(DMD)患者。目前,DYNE-251用于治疗DMD患者的I/II期DELIVER研究正在进行中,预计2023年下半年公布具体实验数据。 杜氏肌营养不良症(Duchenne muscular dystrophy,DMD)是一种肌营养不良蛋白缺乏引起的X染色体隐性遗传神经肌肉病。DMD在存活男婴中的发病率为1/3000~5000,在我国,每年大约有400~500例DMD患儿出生,总计DMD患者高达7~8万人,是患病人数最高的国家之一。目前,DMD尚无有效治愈手段,基因替代、外显子跳跃、基因组编辑、终止密码子通读等基因治疗逐步成为研究热点。 来源:医药魔方 1.2亿美元助力开发两款免疫疾病精准疗法,天境生物拥有大中华区开发权益 今日,Human Immunology Biosciences(Hi-Bio)公司宣布完成1.2亿美元融资并正式亮相。该公司的目标是针对严重免疫介导疾病,开发精准疗法。其两款抗体疗法已经进入临床开发阶段。 免疫介导疾病包括自身免疫性疾病、过敏和炎症性疾病,高达4%的全球人口受到这类疾病的困扰。这些疾病的靶向疗法较少,通常的治疗手段影响广泛,且未能针对疾病的根本原因。因此,很多患者不但症状缓解有限,而且会经受不必要的副作用。 该公司的的两款临床期在研疗法分别为抗CD38抗体felzartamab,和抗C5aR1抗体HIB210。Felzartamab靶向的CD38在成熟浆细胞表面表达,浆细胞的功能失常驱动多种免疫介导疾病的发生。Felzartamab通过与CD38结合,可清除浆细胞和浆母细胞,消除导致疾病的自身抗体的来源。目前它在临床试验中用于治疗膜性肾病和IgA肾病。HIB210靶向在中性粒细胞中表达的C5aR1,目前在1期临床试验中接受评估。天境生物拥有felzartamab在大中华区的开发权益,以及HIB210在大中华区和韩国的开发权益。 来源:药明康德 单次注射半年有效!抗衰老机制药物关键临床试验即将启动 UNITY Biotechnology今日宣布其基于抗衰老机制的在研药品UBX1325,于临床2期试验中,达成关键安全与疗效终点。数据分析显示,糖尿病性黄斑水肿(DME)病患在经过药物单次注射后,其视力与视网膜可获得改善长达24周。UNITY预计于2023年下半年启动关键临床试验。 糖尿病性黄斑水肿影响全球约2100万人,是工作年龄成年人视力丧失的主要原因。当血管损伤和新血管形成导致血液和/或液体泄漏到视网膜时,就会发生糖尿病性视网膜病变(DR)。当受损的血管引起黄斑(视网膜的**区域,负责阅读和驾驶所需的敏锐视力)肿胀时,就会发生DME。目前DME的标准疗法是最初接受每月3-5次靶向血管内皮生长因子(VEGF)药物的注射再加上每隔8周的剂量补充,但这样频繁眼部注射对病患产生显著的治疗负担。 UBX1325是一款在研细胞凋亡抑制蛋白Bcl-xL***。随着人们的衰老,体内的组织中会出现衰老细胞(senescent cells)。这些细胞不但自身功能失常,还会分泌有害物质,引发炎症并影响周围健康细胞的功能。UBX1325可以抑制衰老细胞赖以存活的蛋白质功能。在临床前实验中,UBX1325可以借着靶向Bcl-xL,选择性地消灭疾病组织中的衰老细胞,但却不会伤害健康组织。在治疗晚期湿性年龄相关性黄斑变性(AMD)与糖尿病性黄斑水肿的临床1期试验中,此药物展现良好的安全性,并在单次玻璃体内注射后可以持续维持视力改善达24周。 来源:药明康德 166亿美元!强生拟收购人工心脏巨头Abiomed 11月1日,强生宣布,将通过要约形式收购Abiomed所有流通股,预付款为每股380.00美元现金,总交易金额约166亿美元。 此消息一出,Abiomed盘前大涨51%。Abiomed是全球领先的心血管医疗技术巨头,拥有首创的治疗冠状动脉疾病和心力衰竭的产品组合。根据协议,如果达到某些临床和商业里程碑,Abiomed有权获得每股高达35.00美元的额外现金。 该交易将进一步巩固强生在心血管领域的创新者地位,也将提高未满足需求疾病(心血管和康复等)的标准治疗手段。一直以来,心血管疾病是第一大死亡原因,所有形式的心血管疾病都会导致心力衰竭,由于住院和住院时间延长,对卫生系统来说是一项重大成本。 来源:医药魔方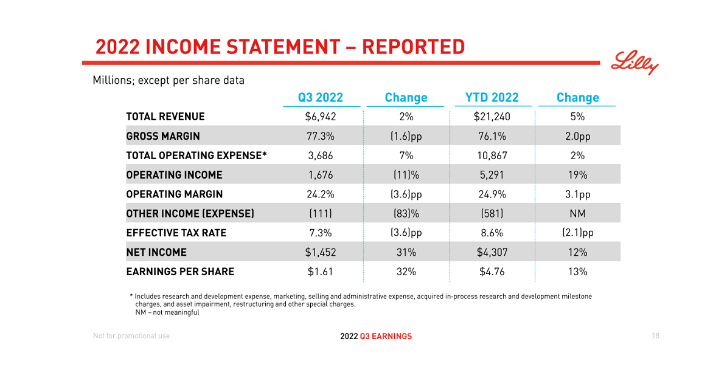





最新医药动态
更多»相关资讯
更多»- 1最全解析!两票制对生产企业、代理商的影响
- 2刚刚13亿美元!诺华引入Voyager新型基因治疗
- 3关于公示2017年度第二类疫苗参考价的通知
- 4争议:NRAS驱动癌症的新靶点——STK19
- 5截至2月11日:累计确诊44653例 治愈出院4740例 死亡1113例
- 6强生出手!跨国五巨头分食百亿市场
- 7关于辽宁省2015年医疗机构直接挂网采购药品建立配送关系的通知
- 8感冒药等大批常用药药价涨了近三倍
- 9药事日报318期 | 华兰疫苗即将登陆创业板!这项药物临床被叫停!
- 10药事日报397期 | 北京房山区卫健委副主任杨大庆等三人接受审查调查!
- 11关于公示广州白云山天心制药股份有限公司注射用头孢呋辛钠限价的通知
- 122018年中国医药行业发展现状及市场前景预测
- 13关于发布辽宁省2017年第1号药品短缺预警预报的通知
- 14仿制药一致性评价最新进展:受理号达1289个 通过308个
- 15医保局《2019年国家医保药品目录调整工作方案》实施内容
 扫一扫关注医药之梯微信二维码
扫一扫关注医药之梯微信二维码
 个人登录
个人登录  企业登录
企业登录 
