美国FDA批准Ionis-AstraZeneca的神经疾病药物
时间:2023/12/25来源:药研网阅读:162
12月22日,FDA网站显示,由阿斯利康和Ionis公司联合开发的反义寡核苷酸疗法Wainua已在美国获批上市,用于治疗成人遗传性转甲状腺素蛋白(TTR)介导的淀粉样变性的多发性***(ATTRv-PN)。

该药物名为Wainua,被批准用于多发性***或遗传性转甲状腺素蛋白淀粉样变性(ATTR-PN)引起的神经损伤患者。
ATTRv-PN
甲状腺素运载蛋白淀粉样变性是一种可能致命的心肌疾病,其特征是身体器官和组织中异常蛋白质沉积的积累。这种疾病会对大脑和脊髓以外的神经造成损害,如果不及时治疗,可能会在十年内致命。该病影响全球约40,000名患者。该病累及许多器官和系统,目前还没有可治愈的药物,仅有一些药物可以减缓疾病的进展。
Wainua 是唯一获批用于治疗 ATTRv-PN 的药物,患者可以通过每月一次,通过皮**射自行给药。
与较旧的Ionis药物相比,它使用一种较新的技术,这种新药可以自行给药,并且比以前批准的疗法需要更少的剂量旨在靶向产生蛋白质的肝脏。
FDA的批准是基于一项在ATTRv-PN成人患者中开展的随机、开放标签、多中心的临床3期试验,名为NEURO-TTRansform。该分析显示,在接受治疗35周时,与外部安慰剂对照相比,Wainua治疗导致患者在改良***损伤评分+7(mNIS+7)和生活质量指标(Norfolk QoL-DN)总分上出现统计学显著改善(p<0.001)。
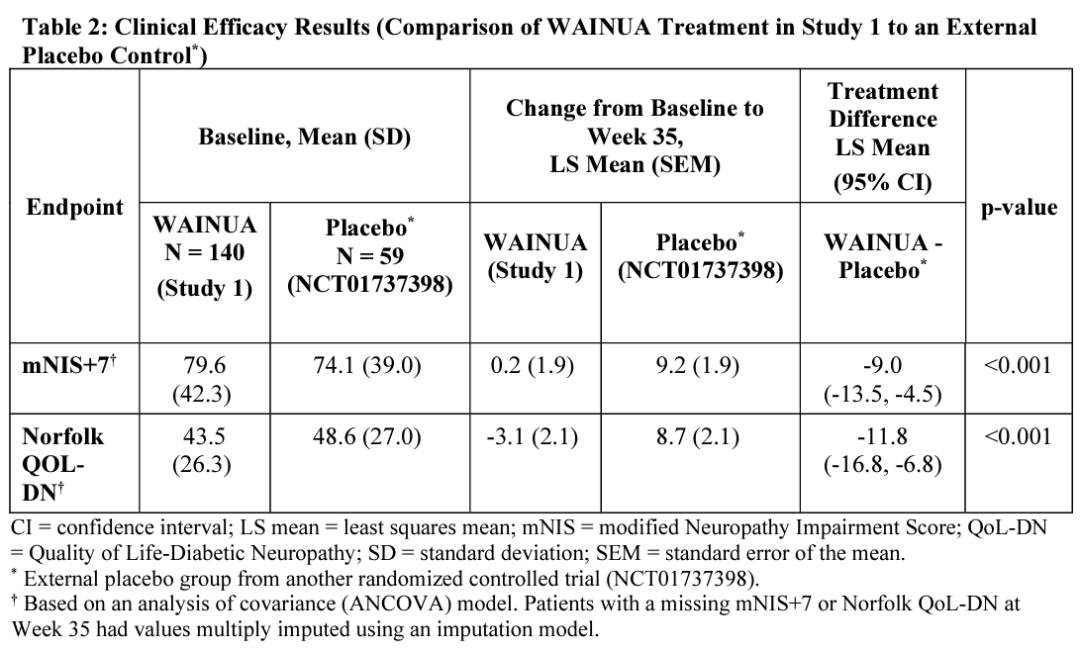
该试验的积极结果发表在《美国医学会杂志》(JAMA)上,进一步证明了Wainua在35、66和85周时对ATTRv-PN的益处。
该试验研究员表示:“许多患有遗传性转甲状腺素蛋白介导的淀粉样多发性***的人无法充分享受他们的生活,因为这种疾病的无情,渐进和衰弱的影响。Wainua的批准代表了治疗方面有意义的进步,它为那些患有转甲状腺素蛋白介导的淀粉样多发性***的人提供了帮助控制疾病。
最新医药动态
更多»相关资讯
更多»- 1药事日报410期 | 广西金嗓子药业小儿感冒颗粒等10批次药品不符合规定!
- 2齐鲁制药申请药品降价吉非替尼片挂网价下调为498元/盒降幅69%
- 3190亿抗病毒市场风云蝶变,10个抗艾新药入局排名大变更
- 4关于对辽宁省2015年医疗机构药品集中采购(招标采购部分)限价再次公示的通知
- 5医保谈判失利的国产新药,和一家本土药企的困境
- 6关于进一步明确2015年度贵州省药品集中采购投标人网上信息申报有关事项的通知
- 72018年全球最强医药企业前20强榜单
- 8关于公示山西省基本药物新增备选企业的通知
- 9“4+7”扩围拟中选结果:与试点中选价格相比平均降幅25%
- 102019海盐县人民医院最新招聘信息
- 11顺丰入局医药行业,配送成本最高节省80%!接下来顺丰怎么干?
- 12继奥希替尼后,这家药企又拿下10亿抗肿瘤药首仿
- 13圣因生物PCSK9 RNAi疗法在国内启动I期临床试验
- 14中国生物制药公布2019年中期业绩,营收125.27 亿元净赚 14.4 亿
- 15三天三家上市药企集体更换审计机构 原因几何
 扫一扫关注医药之梯微信二维码
扫一扫关注医药之梯微信二维码
 个人登录
个人登录  企业登录
企业登录 
