武田押注5.1亿美元的CRISPR编辑TIL疗法获IND批准
时间:2023/12/01来源:医麦客阅读:188
2023年11月29日,KSQ Therapeutics与MD安德森癌症中心细胞治疗制造中心(CTMC)宣布,美国FDA已批准经CRISPR编辑的靶向CT-1自体eTIL疗法KSQ-001EX的1/2期临床研究的新药临床试验(IND)申请,针对黑色素瘤、头颈部鳞状细胞癌(HNSCC)和非小细胞肺癌(NSCLC)。
CT-1视为是可以增强人体肿瘤浸润淋巴细胞扩增和体外细胞因子产生的最佳靶点,潜在活性优于PD-1,经过CT-1编辑的T细胞在体内的抗肿瘤活性可以增加10倍。此外,KSQ-001EX通过CRISPR/Cas9 基因编辑使SOCS1基因失活,为KSQ-001EX在实体瘤治疗方面提供了一流的潜力。与其他细胞疗法相比,工程化肿瘤浸润淋巴细胞eTILs提供了降低剂量和减少患者治疗条件的可能性,潜在地改善了患者体验。简化eTIL的制造工艺保证了更简单、更快速的肿瘤到静脉的周转时间。
在临床前研究中,KSQ-001EX在PD-1抑制难治的实体瘤模型中显示出增强的抗肿瘤功能与T细胞持久性。1/2期临床试验是一项针对黑色素瘤、头颈部鳞状细胞癌(HNSCC)和非小细胞肺癌(NSCLC)患者的开放标签、安全性导入研究。该试验的 1 期部分的主要目的是评估 KSQ-001EX 的安全性和耐受性,一组患者最初将接受不含 IL-2 的给药。第 2 阶段的主要目标是评估特定适应症队列中的抗肿瘤活性。另一款KSQ-004的eTIL疗法针对于Regnase-1基因,也朝着治疗实体肿瘤的临床研究前进。
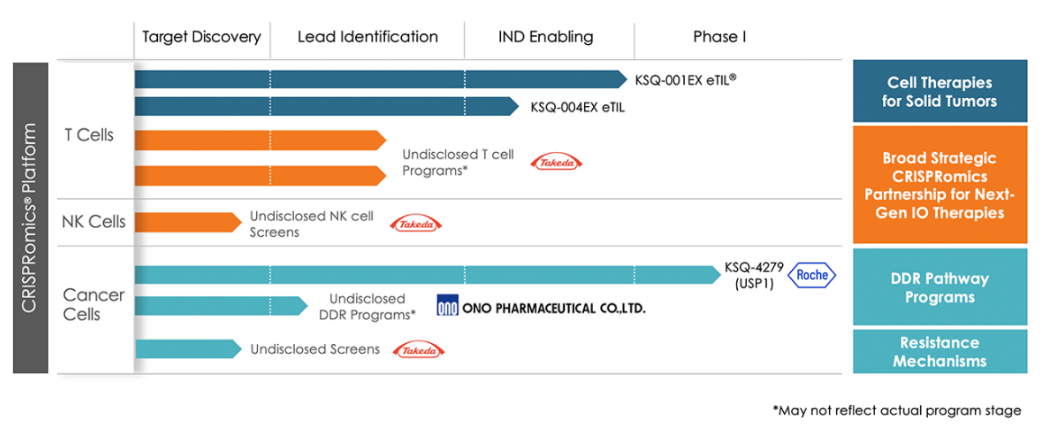
▲ KSQ在研管线 图片来源:KSQ官网
KSQ Therapeutics
KSQ Therapeutics是美国马萨诸塞州的一家生物制药公司,成立于2015年,致力于开发以肿瘤和免疫为重点的治疗癌症的候选药物。KSQ基于Tim Wang博士的技术创立,他发明了一种突破性的功能基因组学技术,利用CRISPR-Cas9系统构建全基因组单向导RNA(sgRNA)库,筛选可以用于癌症靶向治疗的基因。Tim Wang曾入选2017年《福布斯》杂志“30 under 30”榜单。
KSQ 的药物发现和开发工作以其专有的 CRISPRomics™技术平台为引擎,利用一套专有的 CRISPR / Cas9 工具以前所未有的规模和更高的精确度针对每个人的基因产生相关疾病的治疗方案。KSQ 已经把该技术平台细分为多个不同平台,并从基因角度验证药物发现的最优新型靶点。CRISPRomics™在多个治疗领域具有广泛应用,包括肿瘤、肿瘤免疫、自身免疫疾病以及罕见病等。
CRISPRomics™平台能够快速发现新的药物靶点,并排除数千个不相关的靶点。CT-1就是运用CRISPRomics技术,进行多基因组规模的体内T细胞筛查过程中发现的。基于该平台,KSQ对600多个癌症模型中20000个人类基因的功能进行了筛选,建成了一个庞大的数据库,使公司能够确定治疗癌症和自身免疫性疾病的最佳基因靶点,系统地探究乃至同时测试20,000个基因在不同疾病模型中的功能。
2023年5月17日,KSQ宣布扩大了与武田的战略合作,以研究和验证新的肿瘤内在靶点。根据协议条款,武田将向KSQ提供一笔预付款和数百万美元的投资。如果在协议期限内实现所有里程碑,KSQ还有资格在未来获得高达5.1亿美元的付款,加上合作产生的任何商业产品的潜在净销售额的版税。在初次合作后的2年扩大KSQ与武田的成功合作伙伴关系,进一步验证了CRISPRomics平台在各种模式的各种细胞类型中发现令人兴奋的新靶点的有效性,也证明了KSQ交付成果的能力。
2023年11月29日,华赛伯曼宣布,公司自主研发的首款TIL细胞1类新药——HS-IT101注射液(受理编号:CXSL2300599)用于治疗晚期实体瘤的IND申请获得NMPA临床试验默示许可,这也是华赛伯曼首款获批进入临床的产品。华赛伯曼具有独创的全自动化工艺生产平台PowerTexp®,是目前有报道的唯一一家实现TIL细胞培养全封闭自动化工艺的企业,凭借着强大的工艺优势,HS-IT101有着超过95%的培养成功率,为未来临床快速推进*实基础。同时HS-IT101注射液还有着微量肿瘤组织即可满足生产需求,制备周期短,临床端低剂量白介素2用药等特点,大幅降低了临床试验的难度,目前已确定中国医学科学院肿瘤医院作为一期组长单位,李宁副院长作为牵头PI,完成了立项和伦理的审批,未来将快速启动一期临床试验。

▲ 图片来源:CDE官网
11月中旬,君赛生物开发的全球首款无需清淋、无需IL-2注射的天然TIL细胞新药GC101的临床试验取得重要进展。以黑色素瘤作为首个优选适应症,GC101已获准在国际权威的恶性黑色素瘤治疗中心——北京大学肿瘤医院开展临床验证,并由中国临床肿瘤学会(CSCO)副理事长兼秘书长郭军教授担任此项临床研究的PI。目前,已有多个癌种多例晚期实体肿瘤患者经GC101回输治疗,总体客观缓解率超过35%(肿瘤缩小30%以上),其中3例患者肿瘤被完全清除,无瘤生存最久时间已超2年。所有受试者均未发生与GC101相关的SAE(严重不良事件),安全性良好。
2023年11月3日,百吉生物申报的BST02注射液新药临床试验(IND)申请获得CDE正式受理,用于治疗所有类型肝癌。此次CDE正式受理,是百吉生物IND申报里程碑又一重大推进。今年10月26日,美国FDA批准了BST02的I/II期临床试验申请。BST02成为全球首款进入临床阶段针对肝癌的TIL细胞治疗药品。值得一提的是,BST02是冻存产品,突破了距离的限制,且不需要高剂量白介素-2伴随用药,其安全性和有效性已在探索性临床中得到初步验证。
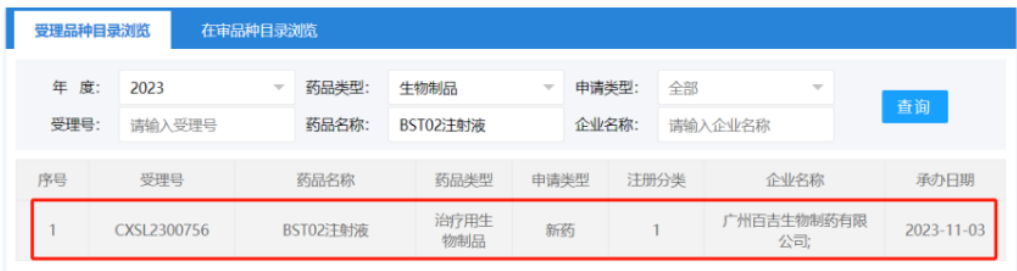
▲ 图片来源:CDE官网
总结
今年11月,全球首款CRISPR基因编辑疗法exa-cel获批上市,而明年TIL细胞疗法也将实现0的突破!未来,CRISPR基因编辑与TIL细胞疗法的“双手连弹”还有许多可想象,能探索的空间,也将进一步刺激国内TIL疗法在创新领域有更好地发展。
参考资料:
1.https://www.biospace.com
2.各企业官网
最新医药动态
更多»相关资讯
更多»- 1关于更新新一轮药品交易产品目录分组结果的通知
- 2药事日报 232期 | 康希诺生物等向上药康希诺增资约11亿元 违规解雇代表 知名药企被罚......
- 3药事日报206期|默克/Day One合作开发MEK抑制剂Pimasertib、康希诺生物重组新冠病毒疫苗获受理
- 4关于17家企业名称变更的公告
- 5药事日报236期 | 国家药监局批准康替唑胺片上市 博腾生物宣布与凯地生物达成战略合作
- 6全面解析新版医保目录对医药全行业的影响(上):一大批辅助用药出局!
- 7复宏汉霖EGFR靶向ADC获FDA快速通道资格
- 8药事日报184期|国药控股董事长与股份总经理同日辞职、百济PD-1第三个适应症获批上市
- 9印度药企开启快速入华模式 下一个会是谁?
- 10美国FDA批准荣昌生物泰它西普开展治疗成人活动性原发性干燥综合征 Ⅲ 期全球多中心临床研究
- 11依图医疗携手华为 率先进入医疗“智能云”时代
- 12裁员680人 诺华计划重组其全球研发团队
- 13基石药业宣布欧洲药品管理局已受理舒格利单抗用于治疗转移性鳞状和非鳞状非小细胞肺癌的上市许可申请
- 14新开源公布2018年年报:营收6.98亿元 精准医疗业务稳步增长
- 15国产首款!信达OX40L单抗IBI356启动临床
 扫一扫关注医药之梯微信二维码
扫一扫关注医药之梯微信二维码
 个人登录
个人登录  企业登录
企业登录 
