药事日报481期 | 这家药企完成更名!拜耳完成向Cinven出售环境科学业务!
时间:2022/10/09来源:医药之梯阅读:383

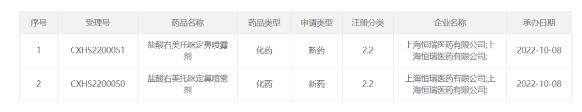
针对抑郁症!广为医药1类新药获批临床 近日,广为医药宣布,该公司自主研发的NMDA受体部分激动剂GW201口服片已在中国获批临床,拟开发用于治疗抑郁症。 截图来源:CDE官网 NMDA受体是目前抗抑郁药研发中比较受关注的一个新兴靶点。与传统的5-羟色胺、多巴胺或去甲肾上腺素靶点相比,以NMDA受体为靶点的药物在起效时间、对难治性抑郁(TRD)治疗效果方面具备明显优势。与GABAA受体等其它靶点相比,该机制药物的治疗效应更加偏重于抑郁症核心症状的改善。2019年,首个NMDA受体机制的抗抑郁药Spravato(esketamine)鼻喷剂获得美国FDA批准上市,被誉为50年以来首个新机制抗抑郁药。今年8月份,Auvelity(右美沙芬+安非他酮)获得FDA批准上市,成为该机制首款口服疗法。 来源:广为医药 礼来RET***在中国获批,惠及特定肺癌和甲状腺癌患者 10月8日,礼来公司(Eli Lilly and Company)宣布,其高选择性转染重排(RET)***塞普替尼(selpercatinib)的新药上市申请已获得中国国家药监局(NMPA)批准,用于治疗RET基因融合阳性的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者、需要系统性治疗的晚期或转移性RET突变型甲状腺髓样癌(MTC)成人和12岁及以上儿童患者、以及需要系统性治疗且放射性碘难治(如果放射性碘适用)的晚期或转移性RET融合阳性甲状腺癌(TC)成人和12岁及以上儿童患者。公开资料显示,塞普替尼是首个获批专门用于治疗携带RET基因变异癌症患者的精准疗法。 2021年11月,中国国家药品监督管理局药品审评中心(CDE)受理了塞普替尼胶囊的上市申请,并将其纳入优先审评。2022年3月,礼来公司与信达生物进一步深化肿瘤领域的战略合作,其中包括信达生物获得塞普替尼在中国的独家商业化权利。 来源:礼来公司 拜耳完成向Cinven出售环境科学业务 2022年10月5日,德国勒沃库森 – 继3月份达成相关协议,拜耳正式完成向国际私募股权公司Cinven出售其环境科学业务 (Environmental Science Professional business)。交易完成的条件——包括收到监管部门的批准——现在已经得到满足。 该业务在2021年的销售额约为6亿欧元,其收购价格为26亿美元(26亿欧元)。据悉,拜耳此次交易的净收益将用于减少公司净财务债务。 来源:一度医药 口服新冠疫苗I期临床数据积极 10月7日,Oramed公司宣布,其子公司Oravax Medical开发的口服新冠疫苗I期临床数据积极,达到免疫原性和安全性的主要和次要终点。 该口服新冠疫苗靶向新冠**的3种主要表面蛋白,包括刺突蛋白(Spike)、包膜蛋白(Membrane)和膜糖蛋白( Envelope),对现有流行株和新变异株都可以提供保护。 来源:Oramed公司 华领医药first in class降糖药「多格列艾汀」获批上市 10月8日,华领医药开发的first in class降糖药多格列艾汀(dorzagliatin)正式获得NMPA批准上市。 2020年8月华领医药与拜耳达成合作,华领医药作为药品上市许可持有人负责临床开发,注册,产品供应以及分销工作。拜耳作为推广服务提供方负责该产品在中国的市场营销,推广以及医学教育活动。华领医药将获得3亿元人民币的预付款,此外其还将获得额外最高可达到41.8亿元人民币的里程碑付款。拜耳获得该产品在中国独家商业化的权利,并将根据华领净销售额的一定比例获得服务费用。 来源:医药魔方 首款用于妊娠期的疫苗!FDA扩大Boostrix接种群体 10月7日,FDA扩大批准GSK的Boostrix(一种Tdap疫苗)在妊娠晚期(27~36周)群体中的接种,用以预防婴儿百日咳。该批准是基于一项观察性真实世界对照研究的数据。 “百日咳是一种高度传染性的呼吸道疾病,影响所有年龄段。然而,婴儿患百日咳的风险最高,并因此出现严重并发症,”FDA生物制剂评估和研究中心主任Peter Marks博士表示,“虽然接种疫苗是提供保护的最佳途径,但2个月以下的婴儿太小,无法受到儿童百日咳系列疫苗的保护。这是FDA批准的首款用于妊娠期的疫苗,用于预防妊娠母亲所产的新生儿发病。” 来源:医药魔方 dMed-Clinipace公司更名为Caidya(康缔亚) dMed|Clinipace正式宣布更名为Caidya(康缔亚)。Caidya(康缔亚)由两家领先的CRO公司,缔脉与Clinipace在2021年正式合并组成, 在全球30多个国家和地区拥有近1,800名员工。 dMed(缔脉)与Clinipace于2021年4月合并,此次公司品牌变更宣告了dMed和Clinipace原有业务已成功整合。康缔亚服务范围覆盖亚太、欧洲、拉丁美洲以及北美等地区,遍及全球。康缔亚服务内容多样,从临床试验申请到临床试验运营,直至新药上市申请和上市后监测,康缔亚为客户提供全方位的临床研发全生命周期支持,并为客户提供定制化、高度灵活的交付模式。康缔亚在肿瘤、罕见病、神经疾病、传染病以及呼吸系统疾病等多个治疗领域拥有广博的专业知识和经验。 来源:美通社 又一个2.2类!恒瑞「盐酸右美托咪定鼻喷雾剂」申报上市 10月8日,CDE官网显示,恒瑞2.2类新药盐酸右美托咪定鼻喷雾剂第2个适应症提交上市申请并获受理,用于儿童术前镇静(如儿童全身麻醉)。盐酸右美托咪定鼻喷雾剂是改良型新药,相比注射剂,鼻喷雾剂生物具有利用度高、给药方便等优点,尤其适用于儿童。 来源: CPhI制药在线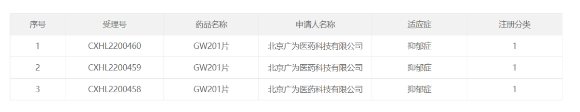



最新医药动态
更多»相关资讯
更多»- 1药事日报302期 | 恒瑞医药又一类药物获批上市;多家药企完成融资
- 2川药械采〔2017〕22号关于开展常用低价药品挂网采购工作的通知
- 3豪森药业「恩格列净」首仿即将获批
- 4浙江省首家生物药生产企业“政企服务空间站”落户富阳
- 52019创业公司倒闭名单:医疗健康领域19家
- 66月1日起,社区养老相关服务收入免征增值税,相关房产土地等免征契税、城镇土地使用税等6项收费
- 7转发国家卫生计生委等部门关于2016年临床必需、用量小、市场供应短缺药品定点生产试点有关事项的通知
- 8截至2018年11月28日,通过一致性评品规的121个仿制药汇总
- 9药事日报397期 | 北京房山区卫健委副主任杨大庆等三人接受审查调查!
- 10药事日报511期 | 60亿元!复星医药引进复宏汉霖「斯鲁利单抗」商业化权益!
- 11中国医药领域5大顶级试点政策 你都了解吗?
- 12药事日报242期 | 强生(JNJ.US)宣布将取消在印度本地的新冠疫苗试验 湘泉药业董事邓淞元辞职
- 13药事日报201期|阿斯利康Imfinzi一线治疗头颈部癌症3期临床失败、港交所基因测序第一股贝康医疗上市
- 14关于公示青海省第二类疫苗集中采购产品信息结果的通知
- 15中恒集团获莱美药业控制权 高管却回应不知情?!
 扫一扫关注医药之梯微信二维码
扫一扫关注医药之梯微信二维码
 个人登录
个人登录  企业登录
企业登录 
