药事日报508期 | 超14亿!豪森引进这一双抗;云顶新耀引进的肾病新药在中国申报上市!
时间:2022/11/15来源:医药之梯阅读:293

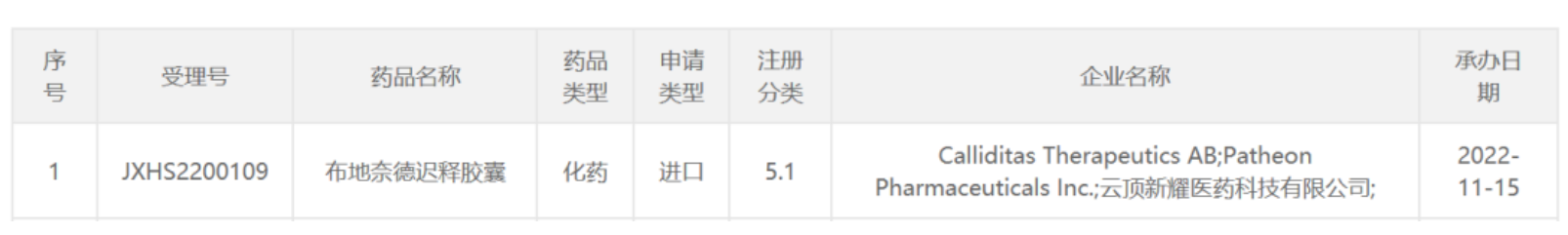
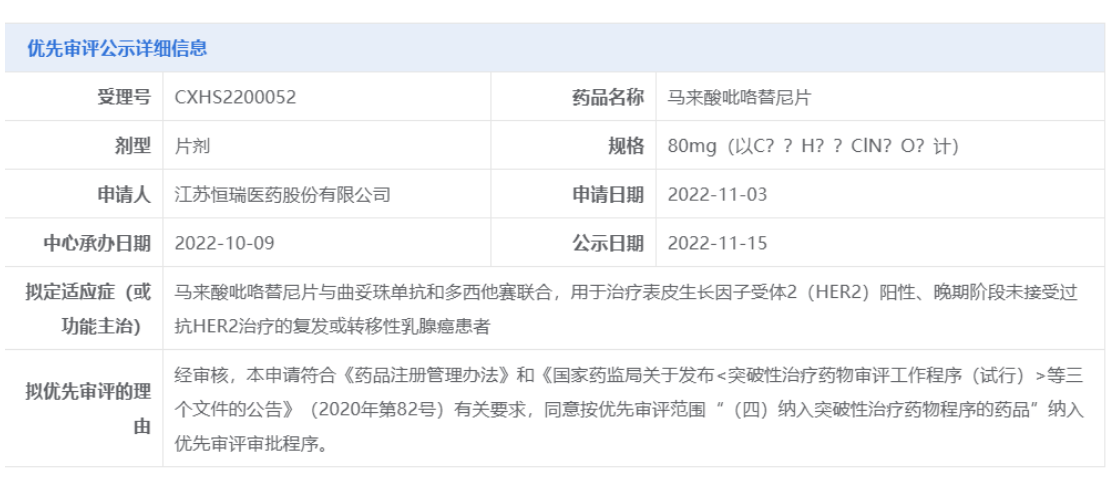
5000万首付!豪森14.68亿元引进普米斯一款临床前EGFR/cMet双抗 11月14日,翰森制药宣布其全资附属公司翰森(上海)健康科技有限公司与普米斯生物技术(珠海)有限公司(“普米斯”)订立许可协议,获得普米斯的独家许可于中国(包括香港、澳门及台湾)开发及商业化PM1080的权利。 翰森制药将负责PM1080于中国的开发、注册审批、生产及商业化,为此将向普米斯支付5000万人民币首付款,并在许可协议指定的适应症实现商业化时有资格获得高达14.18亿人民币的里程碑付款,以及基于中国未来淨销售额的分级特许权使用费。 来源:翰森制药 “First-in-class”ADC获FDA加速批准,治疗难治性*巢癌 ImmunoGen公司今日宣布,美国FDA已加速批准其靶向叶酸受体α(FRα)的抗体偶联药物(ADC)Elahere(mirvetuximab soravtansine)上市,作为单药疗法,治疗FRα高表达、对含铂疗法耐药的经治晚期*巢癌患者。 ****者对含铂疗法产生耐药性是成功控制疾病的一个重大挑战。FRα是叶酸受体家族的一员,它以高亲和力与叶酸结合,导致它们被内吞摄入细胞内。之前的研究表明,FRα在76-89%的上皮*巢癌和35-68%的三阴性乳腺癌中高度表达。使FRα成为引人关注的药物靶点。而且,FRα介导的信号通路能够影响肿瘤细胞的分裂和迁移,因此抑制FRα还可能产生一定程度的直接抗癌活性。 来源:药明康德 和黄医药「呋喹替尼」中国3期临床取得积极结果 11月14日,和黄医药宣布,呋喹替尼二线治疗胃癌的FRUTIGA中国3期研究取得阳性顶线结果。该研究旨在评估呋喹替尼和紫杉醇联合疗法二线治疗晚期胃癌或胃食管结合部腺癌(GEJ)患者。和黄医药新闻稿表示,该研究取得了阳性结果,达到了其中一个主要终点,即无进展生存期(PFS)取得具有统计学意义的显著改善。 呋喹替尼是一种高选择性、强效的口服血管内皮生长因子受体(VEGFR)-1、2及3***。VEGFR***在抑制肿瘤的血管生成中起到至关重要的作用。据和黄医药公开资料介绍,呋喹替尼的独特设计使其激酶选择性更高,以达到更低的脱靶毒性、更高的耐受性及对靶点更稳定的覆盖。迄今,呋喹替尼在患者中的耐受性普遍良好,并且临床前研究中展示出较低药物间相互作用的可能性,或使其非常适合与其他癌症疗法联合使用。 2018年9月,呋喹替尼获中国国家药监局(NMPA)批准,适用于既往接受过氟嘧啶、奥沙利铂和伊立替康治疗的转移性结直肠癌患者。在中国,和黄医药与礼来公司(Eli Lilly and Company)在中国范围内合作,负责开发和执行呋喹替尼在中国市场的所有医学信息沟通、推广以及本地和区域市场活动。和黄医药拥有呋喹替尼在中国以外区域的所有商业化权利。 来源:和黄医药 超过1亿美元助力!新锐剑指多肽疗法瓶颈 MBX Biosciences今日宣布完成金额达1.15亿美元的B轮融资。MBX将主要使用所获得的资金于开发其“精准内分泌多肽”(PEP)平台,并推动MBX的先导项目MBX 2109治疗甲状旁腺功能减退症的临床开发。 甲状旁腺功能减退症是一种罕见的内分泌疾病,其特征是甲状旁腺激素(PTH)水平不足,导致血液中低钙和磷酸盐水平升高。大多数患者在甲状腺手术期间损伤,或意外切除甲状旁腺后发生此疾病。钙补充剂和活性维生素D的常规治疗不能有效解决甲状旁腺功能减退的短期症状、长期并发症或生活质量影响。目前尚无恢复生理激素水平的替代治疗。 来源:药明康德 防止视力丧失,新锐开发潜在“first-in-class”口服疗法 日前, Breye Therapeutics公司宣布走出隐匿模式,并获得由诺和诺德和Sound Bioventures领投的400万欧元种子轮融资。这家公司的目标是开发治疗视网膜血管疾病的创新口服疗法,获得的资金将用于推动其主打化合物进入1b期临床试验,并支持其第二款化合物进入支持IND申请的研究。 Breye 有两种新颖且相关的口服疗法来解决 DR 和 AMD。其主打疗法danegaptide最初由Zealand Pharma开发。它是一款口服小分子药物,通过靶向细胞间的间隙连接(gap junction)来维持血管结构的完整性,防止视力丧失。这款药物已经在用于治疗心肌梗塞的临床试验中表现出良好的安全性。 来源:药明康德 速递!云顶新耀引进的肾病新药在中国申报上市 11月15日,云顶新耀宣布中国国家药品监督管理局(NMPA)已受理Nefecon(布地奈德迟释胶囊)的新药上市申请,用于治疗具有进展风险的原发性IgA肾病成人患者。Nefecon由Calliditas Therapeutics公司开发,云顶新耀通过合作引进其在大中华地区、新加坡及韩国的开发和商业化权利。此前,该产品已在中国被纳入突破性治疗品种。 免疫球蛋白A肾病(IgA肾病)是一种与进行性肾损伤相关的慢性、进行性自身免疫性疾病。IgA是体内产生量较多的一种免疫球蛋白,与粘膜免疫密切相关。IgA肾病患者的主要特点是肾小球内出现IgA沉积。 Nefecon是布地奈德的创新口服靶向迟释制剂。布地奈德是一种具有强糖皮质激素活性和弱盐皮质激素活性的糖皮质激素,首过代谢程度极高。Nefecon专为IgA肾病患者研制,迟释胶囊含布地奈德4mg,覆以肠溶包衣,使得药物可以完整无损地到达回肠,每粒Nefecon胶囊中所含的布地奈德包衣微丸,靶向作用于回肠末端的黏膜B细胞,从而减少诱发IgA肾病的半乳糖缺陷的IgA1抗体产生,进而在发病机制上游阶段治疗IgA肾病。 来源:云顶新耀 刚刚!恒瑞医药「吡咯替尼」新适应症上市申请拟纳入优先审评,一线治疗乳腺癌! 今日(11月15日),中国国家药监局药品审评中心(CDE)官网公示,恒瑞医药的马来酸吡咯替尼片的新适应症上市申请拟被纳入优先审评,拟用于治疗HER2阳性、晚期阶段未接受过抗HER2治疗的复发或转移性乳腺癌患者,即一线治疗HER2阳性复发/转移性乳腺癌患者。 马来酸吡咯替尼片是恒瑞医药自主研发的一款口服HER1/HER2/HER4酪氨酸激酶***。作为一种小分子、不可逆、泛ErbB受体酪氨酸激酶***,吡咯替尼通过阻止肿瘤细胞内表皮生长因子(EGFR)和人表皮生长因子受体2(HER2)的同质和异质二聚体形成,抑制其自身的磷酸化,阻断下游信号通路的激活,从而抑制肿瘤细胞生长。 来源:医药观澜 石药集团「重组人TNK组织型纤溶酶原激活剂」新适应症申报上市 11月15日,中国国家药监局药品审评中心(CDE)官网公示,石药集团非全资附属公司石药明复乐递交了一项注射用重组人TNK组织型纤溶酶原激活剂的新适应症上市申请,并获得CDE受理。公开资料显示,该药此前已在中国获批用于急性心肌梗死的溶栓治疗,商品名为铭复乐。根据石药集团此前发布的公开资料推测,该药本次申请的适应症可能为治疗急性缺血性卒中。 铭复乐是利用哺乳动物细胞及采用基因工程技术生产的一种重组蛋白。根据石药集团公告,铭复乐为第三代重组人组织纤维蛋白溶酶原激活剂(rt-PA)产品,是rt-PA的突变体:103位点的天冬酰胺取代苏氨酸(T),117位点的谷氨酰胺取代天冬酰胺(N),296-299位点的4个丙氨酸分别取代赖氨酸、组氨酸和2个精氨酸(K)。相比于传统rt-PA产品,铭复乐具有更长的半衰期,更强的纤溶酶原激活物***-1(PAI-1)的拮抗能力,增强了与纤维蛋白结合的能力。而且铭复乐只需5-10秒内即可完成单次弹丸式静脉注射给药,使用便利,能够使患者更快完成静脉溶栓治疗。 来源:医药观澜




最新医药动态
更多»相关资讯
更多»- 1马云退休前阿里一笔新投资 与医保支付新机制异曲同工
- 2药事日报350期 | 注意!这些药品将被撤销挂网!多项药物今日获批……
- 3关于挂网药品重新维护辽宁等最新采购价及补报名纠错的公告
- 4关于同意变更部分中标药品信息的通知(第十六批)
- 5药事日报307期 | 药企高层变动大潮持续;国家药监局禁止这项的生产、销售、使用!
- 6最新:全国医药商业100强
- 7药事日报327期 |多家药企高层人事变动!礼来四天签订18亿美元订单
- 8药事日报425期 | 腾盛博药新首席业务官任命,曾就任吉利德、GSK等企业高层
- 9国务院再次发文,这次要对医疗器械行业下手了
- 10关于公布2014年浙江省药品集中采购(第一批)低价药中标产品参照价梳理结果的通知(六)
- 11先声药业1类新药「依达拉奉右旋莰醇注射液」即将获批
- 12关于进口药品申报相关事宜的补充通知
- 13机会来了!天津卫健委发布通知执业医师护士条件放宽
- 142018年度中国医药工业百强企业榜单发布 扬子江继续蝉联榜首!
- 15中国医院,将迎来第三次大洗牌
 扫一扫关注医药之梯微信二维码
扫一扫关注医药之梯微信二维码
 个人登录
个人登录  企业登录
企业登录 
