药事日报478期 | 国内第10款PD-1单抗获批!
时间:2022/09/29来源:医药之梯阅读:365

每4个月一次!青光眼/高眼压症新药国内申报临床 9月28日,CDE网站显示,艾伯维子公司艾尔建的贝美前列素植入剂在国内申报临床,用于降低开角型青光眼(OAG)或高眼压症(OHT)患者的眼压。 青光眼是全球范围内导致视力不可逆丧失的主要原因,其特点是眼压升高。眼压升高不受控制将导致视神经损伤和视力丧失,而降低眼压是阻止青光眼进展和青光眼相关视力下降的唯一有效方法。据统计,2019年中国青光眼患者近2200万人,其中闭角型青光眼比例略高,约占56.1%,开角型青光眼约占43.9%。 来源:CDE网站 近岸蛋白今日科创板上市!募资18.6亿元,沃森生物是其最大客户 9月29日,医药原料重组蛋白生产商近岸蛋白在上交所科创板上市。本次发行价格为106.19元/股,发行数量为1,754.3860万股,全部为新股发行,无老股转让。通过此次IPO,近岸蛋白募资总额18.6亿元,扣除将近1亿元的发行成本,净募资额17.4亿元。 近岸蛋白主营业务为靶点及因子类蛋白、重组抗体、酶及试剂的研发、生产、 销售并提供相关技术服务。值得一提的是,2020年以前近岸蛋白净利润还处于持续亏损的状态,其大部分的营收来自于新冠相关业务。疫情爆后,该公司借此推出一系列与新冠**相关的重组蛋白产品,并扭亏为盈,净利润迅速增长。 招股书披露,mRNA原料酶及试剂合计销售金额超过100万元的企业系沃森生物、艾博生物及石药集团三家。其中,沃森生物是该公司mRNA原料酶及试剂的主要客户,2021年度对其销售mRNA原料酶及试剂超过1.2亿元,占公司当期mRNA原料酶及试剂收入比例约为95%,占主营业务收入比例35.82%。 来源:医药魔方 中国自免新药海外授权金额新高!先声药业与Almirall就IL-2项目达成5亿美元交易 9月29日,先声药业宣布与Almirall S.A达成自身免疫候选药物IL-2突变融合蛋白(IL-2 mu-Fc)SIM0278签订独家授权协议。Almirall将获得在大中华以外地区开发和商业化SIM0278所有适应症的独家权利。先声药业将保留SIM0278在大中华地区的所有权利。 根据该协议条款,先声药业将收取Almirall支付的1500万美元首付款,并基于多个适应症的可能成果收取至多4.92亿美元开发和商业里程碑付款(包括部分销售里程碑);另有基于该产品未来在协议地区销售情况的低双位数百分比分级提成。根据魔方数据库,该项协议总金额也创下国内自身免疫领域临床前项目对海外授权最高纪录。 目前,全球尚未有此类工程化IL-2自免疾病治疗药物上市,但国际上已有知名公司安进、默沙东(通过收购pandion获得)、艾伯维(与 Cugene合作)布局了IL-2突变融合蛋白的自免治疗项目,分别处于临床I-II期。其中,2021年默沙东通过大代价(18.5亿美元)收购Pandion,旨在获得该公司的核心资产,一款处于I期临床的IL-2突变融合蛋白PT101(MK-6194)成为行业关注的年度重磅交易。可见,这条尚未进入火热竞争的反向开发之路市场前景看好,受到跨国公司的重视。 来源:先声药业 盐野义3CL蛋白***治疗奥密克戎感染III期试验达到研究终点 9月28日,盐野义(Shionogi)宣布3CL蛋白***Ensitrelvir Fumaric Acid (S-217622)在亚洲进行的II/III期临床试验的III期部分达到主要终点。结果表明,与安慰剂相比,ensitrelvir首次证明能够显著缩短奥密克戎(Omicron)五种典型症状的缓解时间。同时,ensitrelvir在第4天(第三次给药后)也显示出**RNA载量的显著减少。 凭借在奥密克戎大流行阶段进行的这项研究的结果,ensitrelvir成为第一个在症状缓解时间上与安慰剂相比具有统计学显著效果的研究性口服抗**药物。Ensitrelvir是北海道大学和盐野义联合开发的一款口服3CL蛋白酶***,其作用机制与辉瑞获得批准的COVID-19药物Paxlovid相同。SARS-COV-2具有3CL蛋白酶这种**增殖所必需的酶,ensitrelvir通过选择性地抑制3CL蛋白酶,从而达到抑制SARS-COV-2增殖的效果。 来源:盐野义(Shionogi) 口服PI3Kδ***上市申请获FDA受理,治疗罕见免疫缺陷病 9月28日,Pharming Group公司宣布,FDA已受理口服选择性PI3Kδ***leniolisib的新药申请(NDA)并授予其优先**资格,用于治疗12岁及以上青少年和成人PI3Kδ过度活化综合征(APDS)。PDUFA日期为2023年3月29日。 此次上市申请是基于一项II/III期研究的积极数据,该研究达到了淋巴结大小减少和免疫缺陷纠正的共同主要终点。结果显示,与安慰剂相比,leniolisib的疗效显著,受试者淋巴结病变指数较基线有统计学意义上的降低(p=0.006),且免疫功能正常化。另外,与APDS相关的疾病标志物减少,其临床特征包括显著的淋巴细胞增殖和免疫功能障碍,以及淋巴瘤风险增加。 来源:医药魔方 默沙东将新冠口服药授权给国药集团 9月28日,默沙东宣布与国药集团就新冠药莫诺拉韦(molnupiravir)在中国达成合作协议。 根据协议,国药集团将获得默沙东的莫诺拉韦在中国独家进口权和经销权。同时,双方将评估技术转让的可行性,以便该药物在中国境内生产、供应和商业化。 莫诺拉韦是一款口服小分子新冠**治疗药物,目前已在美国、欧盟、澳大利亚、日本等超过40个国家或地区获得上市许可或紧急使用授权。但该药物尚未在中国境内获批。此前曾有消息称,默沙东中国已于6月底向CDE*动递交上市申请。 来源:默沙东 再鼎医药与Seagen就开发ADC产品达成合作 9月27日,再鼎医药和Seagen公司宣布,就Tivdak(tisotumab vedotin-tftv)在中国大陆、香港、澳门和台湾地区的开发和商业化达成独家合作和许可协议。Tivdak是一款“first-in-class”抗体偶联药物(ADC),已经于2021年9月获美国FDA批准上市,用于治疗复发或转移性宫颈癌患者,也是治疗这一患者群体的首款获批ADC。 宫颈癌是导致中国乃至全球女性癌症死亡的主要原因之一,也是继乳腺癌之后死亡率排名第二的女性肿瘤。对于在化疗期间或之后出现疾病进展的复发或转移性宫颈癌患者,现有的治疗选择非常有限。 Tivdak是一种抗体偶联药物,由Genmab公司靶向组织因子(TF)的人源单克隆抗体与Seagen公司的ADC技术组成,将细胞毒性药物、微管**剂单甲基auristatin E (MMAE)利用蛋白酶可切割的接头共价连接到抗体。TF是在宫颈癌细胞表面表达的抗原。Tivdak与表达TF的癌细胞结合,被细胞内吞后通过蛋白水解裂解释放MMAE,它能够扰乱分裂细胞的微管网络,导致细胞周期停滞和细胞死亡。在体外,该药还介导抗体依赖性细胞吞噬作用和抗体依赖性细胞毒性。 来源:医药观澜 国内第10款PD-1单抗获批! 2022年9月29日,NMPA发布公告批准了乐普生物的普特利单抗注射液(受理号:CXSS2101008)的上市申请,适用于既往接受一线及以上系统治疗失败的微卫星高度不稳定(MSI-H)/错配修复功能缺陷(dMMR)实体瘤患者的治疗。 普特利单抗是2018年乐普生物收购泰州翰中而获得的PD-1产品。2021年7月和10月,用于二线或以上黑色素瘤、二线或以上MSI-H/dMMR (微卫星高度不稳定/ 错配修复缺陷)实体瘤的新药上市申请分别获得NMPA受理。 来源:NMPA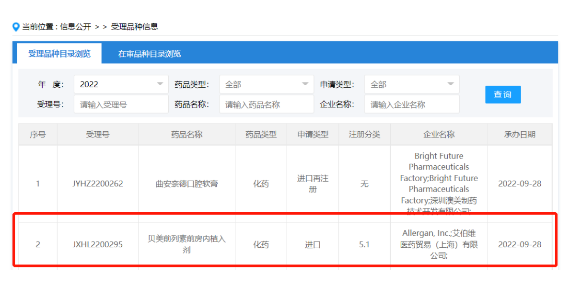






最新医药动态
更多»相关资讯
更多»- 1“医学+X”等新兴学科专业来了!这些人才是如何培养的?
- 2世界医院发展趋势与挑战,医院建设者该做出哪些应对?
- 3药事日报160期|科兴生物23价肺炎疫苗在中国获批上市、和元生物获得腾讯亿元级独家投资拟申报科创板上市
- 4降价谈判 国家重点监控药品被砍25%
- 5浙江医药多款创新药获批临床试验!
- 6扬子江60亿大品种迎来挑战者 地佐辛第2家来了!
- 7药事日报177期|美国可能会将部分现代疫苗的剂量减半以加快推广速度、葡萄牙医护接种辉瑞疫苗2天后死亡此前无任何疾病 原创 小梯子 医药之梯 今天
- 8医药快讯丨华润三九OTC核心品种会考虑适度小幅提价;越洋医药与美国药企签署战略合作协议共同进军GLP-1
- 9药事日报435期 | 英诺特登陆科创板,加速成为呼吸道检测龙头!
- 10药事日报332期 | 凯莱英又签35.42亿元大订单!药企人事变动一览
- 11新药品管理法实施 “药神案”被告取保候审
- 12一心堂门店破6100家 上半年营收破50亿
- 13药事日报241期 | 览海医疗董事、常务副总裁刘蕾辞职 荣昌生物ADC新药拟纳入突破性治疗品种
- 14印度药企开启快速入华模式 下一个会是谁?
- 15大涨177%!Eyepoint湿性AMD药物2期试验成功
 扫一扫关注医药之梯微信二维码
扫一扫关注医药之梯微信二维码
 个人登录
个人登录  企业登录
企业登录 
