药事日报501期 | GSK带状疱疹疫苗Shingrix前三季度销售22亿英镑!辉瑞双特异性抗体获突破性疗法认定!
时间:2022/11/04来源:医药之梯阅读:320
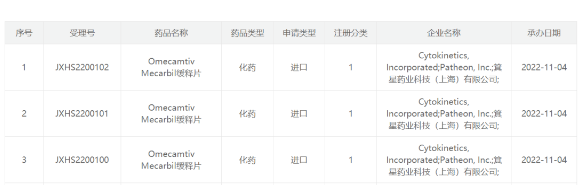
GSK:带状疱疹疫苗Shingrix前三季度销售22亿英镑 GSK公司近日公布2022年Q3业绩。财报显示:该公司Q3销售额为78亿英镑,以实质汇率 (AER)同比增长9%;其中专科药物收入27亿英镑,同比增长24%;疫苗收入25亿英镑,同比增长5%;普药收入26亿英镑,同比增长1%。 值得一提的是,继2022年半年报披露上调全年业绩增长1个点之后,再次将上调了2个增长点。即销售额从预期增长“6%~8%”调高到“8%至10%”;营业利润由此前的预期增长“13%~15%”调整至“15%~17%”。 疫苗领域,带状疱疹疫苗Shingrix表现依旧强劲,Q3销售额达7.6亿英镑,前9个月累计销售额21.89亿英镑,是GSK销售额最高的单品。 来源:医药魔方 信立泰降压药「阿利沙坦酯氨氯地平片」申报上市 11月3日,CDE官网显示,信立泰的阿利沙坦酯氨氯地平片(SAL0107)上市申请获受理,适用于阿利沙坦酯或氨氯地平单药治疗后血压控制不佳的原发性高血压患者。 SAL0107是一款ARB(血管紧张素II受体拮抗剂)/CCB类(钙通道阻滞剂)复方制剂,据信立泰今年上半年财报透露,该药按III期临床方案已完成所有患者的入组,正开展临床随访等工作,具体临床试验结果还未披露。 来源:CDE官网 FDA对两款RSV疫苗“开绿灯” 11月3日,GSK公司宣布,FDA接受其在研二价呼吸道合胞**(RSV)候选疫苗GSK3844766A(RSVPreF3 OA)的生物制品许可申请(BLA),并授予优先审评资格。RSVPreF3 OA为GSK针对老年人的RSV候选疫苗,是由RSV融合前F糖蛋白(RSVPreF3)与GSK专有佐剂AS01组合而成。 FDA预计在2023年5月3日前完成**。若获批,GSK的RSV疫苗可能成为第一个能够保护60岁以上成人,免于因RSV感染而造成的下呼吸道疾病的疫苗。在此之前,欧洲与日本监管机构已接受此候选疫苗的上市申请。 同日,Codagenix公司宣布其用于减毒活鼻内RSV候选疫苗CodaVax-RSV获得FDA快速通道指定。该公司表示,CodaVax-RSV由于采用了基因编辑的方式,可防止野生型回归,加上鼻内给药途径,在动物模型中显示的临床前疗效,具有广泛的全身和粘膜免疫力,具有更可靠的安全性。 来源:医药魔方 创新基因疗法达3期试验双主要终点!上市申请许可递交在即 Abeona Therapeutics今日公布其基因疗法EB-101于关键临床3期试验中的积极结果。数据显示,试验达成两项共同主要终点,此疗法可显著改善隐性营养不良型大疱性表皮松解症(RDEB)患者的大型慢性RDEB伤口的愈合与疼痛程度。Abeona预计于2023年第2季度向美国FDA递交此疗法的生物制品许可申请(BLA)。 RDEB是一种罕见的结缔组织疾病,具常染色体隐性遗传性,表现为皮肤非常脆弱,因日常的轻微摩擦而反复发作产生水疱。RDEB的患儿出生时或出生不久即发生水疱和大面积的皮肤缺损,有时几乎所有皮肤和粘膜表面都有水疱。目前还没有手段去普遍检验RDEB的致病基因。只能在儿童发病后才知道他的父母带有致病基因。此病目前尚未有疗法获批。 EB-101是一种体外基因校正的自体细胞疗法,将COL7A1胶原蛋白基因插入到患者自身的皮肤细胞(角质形成细胞)中,再将这些工程化后的细胞送回患者体内。EB-101能够促进7型胶原蛋白的生产,进而帮助患者的伤口愈合。此疗法已获得美国FDA突破性疗法认定,孤儿药资格、罕见儿童疾病资格以及欧洲药品管理局(EMA)的孤儿药资格。 来源:诺和诺德 90%机率维持难治性肿瘤应答超过半年!辉瑞双特异性抗体获突破性疗法认定 辉瑞(Pfizer)今日宣布,其在研癌症免疫疗法elranatamab获得美国FDA的突破性疗法认定(BTD),用于治疗复发/难治性多发性骨髓瘤(RRMM)患者。Elranatamab为一靶向B细胞成熟抗原(BCMA)与CD3的双特异性抗体。 多发性骨髓瘤是一种目前仍不可治愈的血液细胞癌症,主要影响骨髓内一种称之为浆细胞的细胞。当恶性增生时,这些浆细胞会扩散并取代骨髓内的正常细胞。多发性骨髓瘤是第二常见的血液肿瘤,在全球每10万人中有1.7人罹患此病。在2020年,全世界预估有17.6万人被诊断患有多发性骨髓瘤。虽然少数患者在确诊时并无明显症状,但大部分的病患会出现包含骨折、疼痛、低血红细胞值、疲劳、高钙值、肾脏问题、感染等情形,并为此就医而诊断患有多发性骨髓瘤。目前它仍然是一种无法治愈的血液癌症,几乎所有患者会出现复发并且需要接受后续治疗。随着疾病的进展,每次复发的侵袭性增强,而新疗法获得的缓解期逐渐缩短。 Elranatamab(PF-06863135)是一款靶向B细胞成熟抗原的双特异性抗体。它的一端与BCMA相结合,另一端与T细胞表面的CD3受体结合,从而激活T细胞杀伤表达BCMA的癌细胞。Elranatamab是通过皮**射治疗患者,与静脉注射相较,皮**射较为方便,并可能减缓如细胞因子释放综合征(CRS)等潜在副作用的发生。Elranatamab获得美国FDA与欧洲药品管理局(EMA)的孤儿药资格,用以治疗多发性骨髓瘤。并自FDA与EMA分别获得快速通道资格与优先药品资格,用于治疗复发/难治性多发性骨髓瘤患者。 来源:药明康德 推进难治性抑郁症疗法的开发,新锐完成6000万美元A轮融资 日前,Lusaris Therapeutics公司宣布完成6000万美元的A轮融资,以推进针对严重神经精神性疾病和神经系统疾病的疗法开发。 当重度抑郁症患者对2种及以上的治疗方法没有反应时,就可能进展为难治性抑郁症(TRD),这些患者对于新的治疗方法有巨大的需求。已有研究证明羟色胺能神经功能重塑因子(serotonergic neuroplastogens)可以在结构和功能层面诱导产生有益的神经可塑性,从而使TRD患者的病情得到迅速和显著的改善。现有的临床数据表明,5-甲氧基-N,N-二甲基色胺(5-MeO-DMT)有望为TRD患者提供良好的疗效。 来源:药明康德 全球首款一型糖尿病药物获批在即,Provention Bio股价上涨26% 2022年11月3日,Provention Bio宣布CD3抗体Teplizumab的最新进展,今年2月重新递交上市申请后获得FDA授予突破疗法认证,PDUFA日期为11月17日。今日,Provention收到FDA发出的提议说明书以及上市后要求。Provention称这与公司预期一致,已经进一步推进商业化准备。 受此消息影响,Provention Bio股价大涨26%,目前市值为6.86亿美元。 Teplizumab去年曾首次递交上市申请,但因为生产变更之后未进行PK可比性研究被FDA拒绝批准。合作方礼来选择退回Teplizumab权益,今年10月,Provention Bio宣布与赛诺菲达成合作,赛诺菲以2000万美元获得Teplizumab的优先选择权(ROFN),并对Provention Bio进行3500万美元的股权投资。 来源:医药笔记 箕星药业:重磅心衰药递交上市申请 2022年11月4日,箕星药业Omecamtiv Mecarbil缓释片的上市申请获得NMPA受理。 Omecamtiv mecarbil是一种选择性小分子心肌肌球蛋白激活剂,这款靶向肌节的正性肌力药物作为同类首创的在研新药,可直接靶向心脏收缩机制,与靶点结合后能够增加心脏收缩期间与肌动蛋白相互作用的心肌肌球蛋白头部区域的数量。Omecamtiv mecarbil旨在增加每个心动周期中的活性肌动蛋白-肌球蛋白横桥数量,从而在射血分数降低的心力衰竭(HFrEF)患者中增强受损的心肌收缩力。临床前研究显示,omecamtiv mecarbil可增强心肌收缩力,且不增加心肌细胞内的钙浓度或心肌耗氧量。 2021年12月20日,箕星药业宣布引进Cytokinetics的Omecamtiv Mecarbil,支付5000万美元预付款,2000万美元股权投资,以及3.3亿美元里程碑金额和一定比例的销售分成。 来源:医药笔记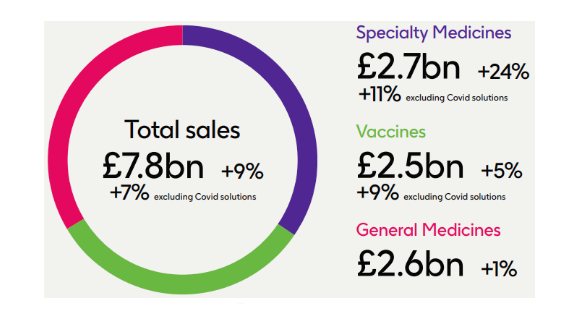






最新医药动态
更多»相关资讯
更多»- 1骨科巨头大动作!
- 2“战略调整”成跨国药企主旋律—裁员与砍管线齐飞
- 3药事日报221期 | 阿斯利康收购知名药企 暴涨195%的抗血栓药 这家湖南药企获批了......
- 4关于公布部分中药饮片的挂网采购信息动态调整的通知
- 5药事日报244期 | 曙方医药与和誉医药达成渐冻症等在研新药大中华地区独家开发协议
- 6关于地高辛口服溶液等定点生产品种挂网采购的有关通知
- 7药事日报340期 | 心脉医疗独立董事辞职!这些药品拟撤销挂网中……
- 8乳腺癌ADC药物DS-8201首次在我国获批
- 9赛诺菲2019Q4业绩预告:集采品种中国区销售额明显下滑
- 10副总裁女儿买股票2天后公司预告业绩大涨,东阿阿胶:她误操作
- 11药事日报470期 | 凯莱英收购Snapdragon折戟……
- 12正大天晴「重组人凝血因子Ⅶa」申报上市
- 13全球最值钱药企TOP10公布!中国药企入围还有多远?
- 14药事日报200期|阿斯利康新冠疫苗单剂效果达76%、罗氏停止多项3期临床试验
- 15药事日报236期 | 国家药监局批准康替唑胺片上市 博腾生物宣布与凯地生物达成战略合作
 扫一扫关注医药之梯微信二维码
扫一扫关注医药之梯微信二维码
 个人登录
个人登录  企业登录
企业登录 
