药事日报506期 | 阿斯利康Q3发布,放弃在美申报新冠疫苗,终止多个项目开发!
时间:2022/11/11来源:医药之梯阅读:222

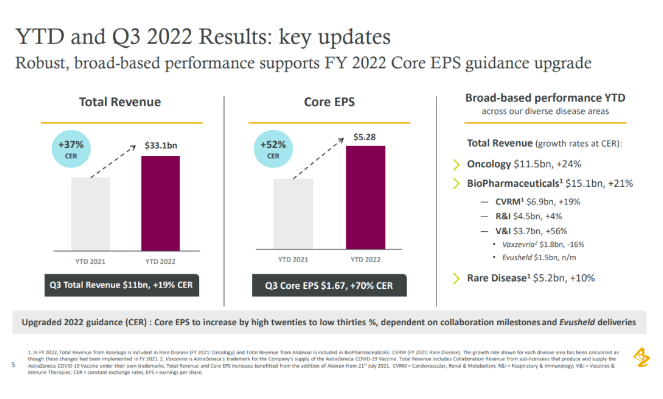
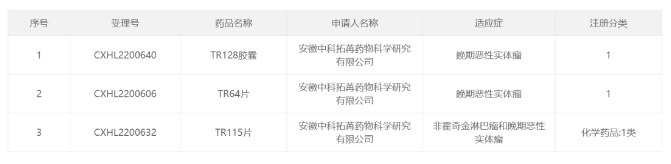
阿斯利康放弃在美国申报新冠疫苗,终止多个项目开发 11月10日,阿斯利康在公布2022Q3业绩的同时也宣布了公司产品和管线的监管和研究进展。 阿斯利康表示,鉴于美国的主要疫苗接种需求已经得到满足,因此不会在美国递交新冠疫苗Vaxzervria的上市申请。并补充说,公司将继续努力,为世界其他地区提供Vaxzeevria,包括递交其作为加强针使用的申请。 第三季度,Vaxzevria的销售额下降至1.73亿美元,而2021年第三季度的销售额高达10.5亿美元。不过,新冠中和抗体Evusheld本季度依然获得了5.37亿美元的销售收入。 管线进展方面,阿斯利康放弃了多款药物的开发,包括:与Moderna合作开发的实体肿瘤候选药物MEDI1191、自研的慢性肾病新药MEDI8367、MCL1***AZD5991以及与Ionis合作开发的PCSK9反义疗法AZD8233等。 来源:医药魔方 5亿美元:Moderna获得和铂医药HCAb技术授权 2022年11月11日,和铂医药宣布与mRNA龙头公司Moderna签订合作协议,后者获得和铂医药重链抗体HCAb技术平台的授权,针对一组靶点用于开发基于核酸的免疫疗法。 根据协议,Moderna将支付600万美元预付款,以及5亿美元里程碑金额,加上一定比例的销售分成。此外,如果Moderna行使额外靶点的选择权,将支付额外的选择权行使付款、里程碑金额及销售分成。 来源:德琪医药 阿斯利康Q3:总收入同比增长37%,中国区收入45.97亿美元! 11月10日,阿斯利康公布2022前三季度业绩,总收入331亿美元,同比增长37%。其中,肿瘤业务115亿美元,同比增长24%;心血管、肾脏及代谢业务69亿美元,同比增长19%;罕见病业务达到52亿美元,同比增长10%。 前三季度,阿斯利康中国区收入45.97亿美元,贡献了阿斯利康新兴市场的一半业绩。 财报显示,阿斯利康的重磅Her2 ADC药物Enhertu(DS-8201)销售额已达到3.87亿美元,这主要得益于其在全球市场的持续放量。特别是Q2,在FDA批准用于Her2阳性乳腺癌二线治疗后,相较于前一个季度直接增长了28%。8月,FDA又陆续批了Enhertu用于HER2低表达乳腺癌 (3rd-line)和非小细胞肺癌(2nd-line)的补充新药申请,进一步促进其销售业绩增长。除此之外,中国已受理Enhertu用于HER2低表达乳腺癌 (3rd-line)的上市申请。 来源:阿斯利康 兆科眼科抗感染滴眼液在华申报上市 11月10日,CDE官网显示,兆科眼科创新药物左氧氟沙星地塞米松滴眼液(NTC010)的上市申请已获受理。 NTC010是一款0.5%浓度左氧氟沙星(一种喹诺酮类广谱抗生素)与0.1%浓度地塞米松(一种皮质类固醇抗炎药)的固定复方制剂,用于预防及治疗白内障手术相关炎症及感染。相比其他滴眼液,NTC010能够减少抗生素使用时长,降低细菌发生耐药的风险,提升老年白内障患者的治疗依从性。 此前,NTC010已在若干欧盟国家获批上市,成为了首款在欧盟地区上市的喹诺酮类抗生素与抗炎类固醇组合的滴眼液产品。2021年2月,兆科眼科与Ntc s.r.l达成合作,取得NTC010在中国的独家许可及分销权。同年7月,NTC010收获海南省药品监督管理局批准,作为进口临床急需药品。 来源:CDE官网 8:5败北!FDA专家委员会反对Veru新冠重症口服药上市 11月9日,美国FDA肺部及过敏性疾病治疗药物专家咨询委员会(PADAC)以8:5的投票结果反对Veru公司的新冠重症口服药sabizbulin上市,认为其临床获益不大于风险。 专家持反对票的原因有:安全性和有效性数据有限;没有充分了解sabizbulin治疗重症新冠的作用机制;与其它获批药物相比,样本量(204名受试者)太少;试验组之间护理标准具有差异等。 根据Veru新闻稿,Sabizabulin是一款口服小分子双吲哚新型微管蛋白***,通过与α和β微管蛋白的"秋水仙碱结合位点"结合,在低纳摩尔浓度下抑制微管蛋白的解聚,从而阻断新冠**沿微管的细胞内运输。同时,该药具有抗炎作用,可以防止新冠**感染引起的细胞因子风暴。 来源:医药魔方 速递!赛默罗生物获1.5亿元C1轮融资 2022年11月8日,上海赛默罗生物科技有限公司(以下简称“赛默罗生物”或“公司”)宣布获得1.5亿元人民币的C1轮融资及数千万元银行贷款,本轮融资由关子创投、天瑞丰年和宜兴华睿共同投资。融资资金计划用于加速推进公司研发管线中多个项目的临床试验和国际合作,以及后续项目的临床前开发。公司成立至今已连续获得深创投、同创伟业、张江高科、广发信德、倚锋资本、高林资本和丰川资本等众多知名机构投资。 公开资料显示,赛默罗生物成立于2014年,是一家以创新为价值导向的全球创新生物科技公司,以缓解及解除广大患者痛苦,提高生活质量为使命,致力于针对疼痛、炎症及中枢神经系统等相关疾病的新药研发。赛默罗生物总部位于中国上海,在广东、江苏,以及澳大利亚、美国等设有分支机构,已建立了完整的药物创新转化平台,围绕核心产品已在全球范围内申请近百项专利,具有完全自主知识产权和全球化市场权益。 来源:赛默罗生物 速递!中科拓苒三款抗肿瘤1类新药获批临床 中国国家药监局药品审评中心(CDE)官网公示,中科拓苒公司(Tarapeutics)三款1类新药于近日接连获批临床。根据中科拓苒新闻稿,三款新药均为该公司开发的新型小分子***,分别针对表观遗传学靶点和肿瘤免疫微环境靶点,以及针对RAF/RAS蛋白突变。 公开资料显示,中科拓苒创立于2019年7月,聚焦全球重大未被满足的临床需求,致力于原创靶向新药的研发。该公司拥有的创新药项目覆盖肿瘤、自身免疫、炎症等疾病领域。2021年7月,中科拓苒宣布完成近亿元A轮融资,由安徽省科技成果转化基金、蚌埠市成长型中小企业基金、中科国元基金、中安旅游大健康基金、安元创新基金、安华创新基金、海南科瑞鸿泰基金、上海山蓝资本等多家投资机构共同参与。 来源:中科拓苒 胃癌一线治疗!基石药业抗PD-L1单抗3期注册临床达主要终点 11月11日,基石药业宣布,择捷美(舒格利单抗注射液)联合化疗一线治疗无法手术切除的PD-L1表达≥5%的局部晚期或转移性胃/胃食管结合部腺癌的GEMSTONE-303研究达到主要终点之一:无进展生存期(PFS)。数据显示,择捷美联合化疗一线治疗将患者的疾病进展或死亡风险降低34%。此外,患者的总生存期也呈现明显获益的趋势。在所有预设亚组中均观察到临床获益。 舒格利单抗是由基石药业开发的一种全人源全长抗PD-L1单克隆抗体,也是一种非常接近人体的天然G型免疫球蛋白4(IgG4)单抗药物,在患者体内产生免疫原性及相关毒性的风险较低。此前,中国国家药品监督管理局(NMPA)已批准该产品上市,用于治疗多种非小细胞肺癌适应症。另外,该药用于治疗复发/难治性结外NK/T细胞淋巴瘤(R/R ENKTL)的新适应症上市申请已获NMPA受理并纳入优先审评。 来源:医药观澜




最新医药动态
更多»相关资讯
更多»- 1创新ADC「德曲妥珠单抗」拟纳入突破性治疗品种
- 2降至百万以下,国产CAR-T价格迎来突破
- 3跨国药企拥抱中国本土创新
- 4有多少家药企上中国500强?19家
- 5全球首款!强生膀胱癌靶向小分子抑制剂获批
- 6全球TOP50制药企业榜单!2家中国药企首次上榜
- 7药事日报348期 | 千金药业外部董事接受纪律审查和监察调查!
- 8国家医保局等九部门联合发文 关于药品集采扩围说了什么?
- 9药事日报226期 | 国家药监局批准颁布第一批中药配方颗粒国家标准 天药股份因违反反垄断法被罚没4402万元
- 10关于调整部分第二类疫苗产品供应价格的通知
- 11国内首个!20亿祛痰药迎来全新剂型
- 12三生国健科创板发行价确定,下周一开启申购
- 13为促进临床急需境外新药审评审批 国家药监局发布最新公告
- 14医药代表这最后的10几天该不该控货?
- 15川药采联办〔2017〕1号关于恢复部分药品挂网资格的通知
 扫一扫关注医药之梯微信二维码
扫一扫关注医药之梯微信二维码
 个人登录
个人登录  企业登录
企业登录 
