斑秃领域新药频现!
时间:2023/12/08来源:赛柏蓝/长风阅读:186
1、斑秃领域新药频现中美价差至少10倍
近日,在部分医院和院外渠道,已经可以开到一款治疗斑秃的新型处方药:辉瑞的甲苯磺酸利特昔替尼(Ritlecitinib,商品名:乐复诺)。
一个多月前,这款药在中国获批上市,用于治疗12岁及以上青少年和成人重度斑秃。乐复诺是一款JAK3/TEC激酶家族双通道***,每日仅需口服一次。它也是全球首款且唯一获批同时用于治疗12岁及以上青少年及成人重度斑秃患者的创新药物。
据悉,这款药在中国的定价为2800元人民币/盒(50mg*30粒),与在美国的价格差异达到10倍之多。
辉瑞的一位发言人此前表示,在不计任何折扣的情况下,美国患者使用利特昔替尼的年费用约为4.9万美元。换算下来,每月费用(即服用一盒)约4083美元,约合人民币2.9万元。
据辉瑞的研究数据,在脱发率高于50%的入组患者中,每日一次服用利特昔替尼组经过24周治疗后,23%的患者头皮毛发覆盖达80%或以上,显著高于安慰剂组的1.6%,达到该研究的主要终点,其中还有13.4%的患者头皮毛发覆盖率超过90%。
斑秃是仅次于雄激素脱发的第二大常见脱发类型,全球约有1.47亿斑秃患者,中国患者约400万人。同时,重度斑秃顽固、难治、易复发,不少患者需长期用药。
目前国内已获批准的斑秃主要治疗方法包括外用、注射糖皮质激素,以及外用米诺地尔。此外,对病情较重,或不宜系统应用糖皮质激素,以及使用糖皮质激素无效的患者,可酌情使用免疫***。
近年来,斑秃治疗领域有了较多进展。除了辉瑞的利特昔替尼,还有一款新药今年也在中国获批。
2023年3月,礼来制药的巴瑞替尼片(商品名“艾乐明”)获批增加适应症,成为中国首个获批用于治疗重度斑秃的靶向药物。三期试验数据显示,在接受治疗36周后,大约三分之一接受剂量为4mg的巴瑞替尼治疗的患者,头皮毛发覆盖面积超过80%,另外三分之一的患者达到眉毛或睫毛完全再生或者没有明显缺失的指标。
巴瑞替尼是礼来和Incyte公司联合开发的口服JAK***,此前已在超过75个国家和地区获批用于治疗类风湿性关节炎患者(包括中国),并在超过50个国家和地区获批用于治疗中重度特应性皮炎。该药于2022年6**美国FDA批准治疗成人斑秃。
与利特昔替尼一样,巴瑞替尼同样为每日口服一次。据美国行业媒体报道,美国斑秃患者服用巴瑞替尼的月费用约为5244美元(按当前汇率折合人民币约3.8万元)。巴瑞替尼上市后,销售保持增长趋势,2021年全球销售额首次突破10亿美元大关,达11.15亿美元。
在中国市场,巴瑞替尼的类风湿性关节炎适应症已被纳入医保目录,挂网价每盒1064元(2mg*28片/盒)。若按治疗斑秃需要每日服用4mg计算,自费月费用为2千余元。
2、还有多款新药即将出现,巴瑞替尼专利权被挑战
目前,针对斑秃的多款药物还在研究中。
其中,艾伯维的JAK1***乌帕替尼片已获CDE新药临床试验默示许可,拟开发治疗重度斑秃适应症,相关三期临床试验正在全球多个地区进行中。
与礼来的巴瑞替尼一样,乌帕替尼也是一款老药。
乌帕替尼缓释片2022年首次在国内获批上市,用于治疗中重度特应性皮炎。随后获批多个适应症:中重度类风湿性关节炎、活动性银屑病关节炎、中重度活动性溃疡性结肠炎、中度至重度活动性克罗恩病等。此外,该药在全球获批的适应症还包括活动性强直性脊柱炎、活动性非放射学中轴型脊柱关节炎等。艾伯维预计,2025年乌帕替尼的销售额将超过75亿美元。
此外,中国药企也有多个同靶点药物进入了临床阶段。其中,恒瑞和泽璟制药是JAK***研发领域进度靠前的企业。
恒瑞医药子公司瑞石生物的JAK1***艾玛昔替尼片(SHR0302),在2期研究中取得了不错的结果数据,三期临床正在进行中。
SHR0302目前已开展了包括类风湿性关节炎、溃疡性结肠炎、特应性皮炎、斑秃、银屑病关节炎等多领域的临床研究。2021年1月,SHR0302片被国家药监局授予了突破性疗法,用于治疗成人及12岁以上青少年的中重度特应性皮炎,目前Ill期临床结果已经达到了共同主要终点及次要终点,恒瑞已于2023年6月递交了该适应症的上市申请。
泽璟制药的JAK1/2/3***杰克替尼同样处于三期临床阶段,并于去年9月获FDA批准开展用于治疗重症斑秃的临床试验。
此外,四川科伦博泰的1类新药KL130008胶囊也于去年4月获批临床,将针对重度斑秃开展临床试验。启元生物的JAK1/TYK2***QY201也已在中国获批开展针对斑秃等的临床试验;此外,先声药业、微芯生物、再极医药等药企均在JAK靶点或斑秃领域有所布局。
同时,CDE专利登记平台显示,巴瑞替尼的专利将于2029年到期。一些国内药企的仿制药也在进展中。
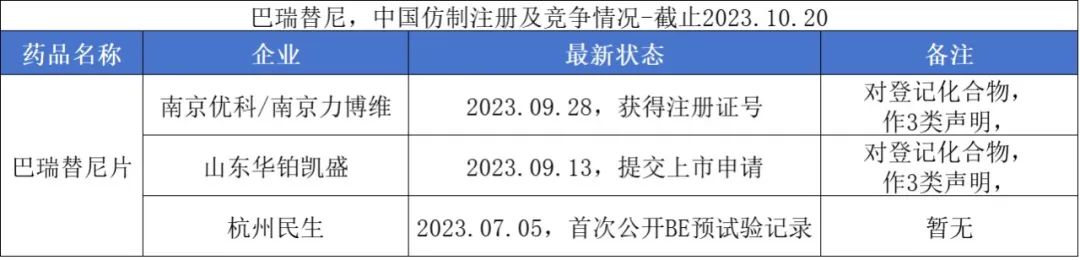
2023年10月13日,南京优科生物子公司南京力博维制药研发的巴瑞替尼片仿制药获批上市,这也是国内首个获得批准的巴瑞替尼仿制药。今年9月,泰恩康全资子公司山东华铂凯盛生物的巴瑞替尼片上市申请获国家药监局受理。不过,由于原研化合物专利的存在,两家公司都已进行专利声明:在2029年3月10日不上市销售。此外,杭州民生在2023年7月首次公开巴瑞替尼的BE预试验记录。
此外,据此前国家知识***公开信息,巴瑞替尼的中国化合物专利无效案件应已在2023年11月8日进行口审。不过相关结果暂未公布。
最新医药动态
更多»相关资讯
更多»- 1关于第一批其他挂网药品入围企业及药品公示的函
- 2药事日报456期 | 翰森制药发布2022年中期业绩报告!
- 3艾迪药业今日科创板上市,抗艾滋病新药预计年底报产
- 4尧唐生物体内基因编辑药物获批临床
- 5IgA肾病治疗药物新上市!一条隐秘的蓝海赛道浮出!
- 6关于11家企业名称变更的公告
- 7骨科巨头大动作!
- 8医药快讯丨每天一分钟,知晓医药事 3月7日
- 9川药采联办〔2017〕5号关于公布执行2015年四川省公立医院药品集中采购双信封招标和谈判(议价)中标结果(第一批)的通知
- 10关于落实地高辛口服溶液等3个国家定点生产药品采购的通知
- 11药事日报272期 | 阿斯利康5亿美元收购新锐 首款!FDA批准儿童肝脏疾病创新疗法
- 12多家企业布局 试剂盒日产量达77.3万人份 7款产品通过应急审批
- 13石药前三季度营收167.61亿元 8大创新药“领军”
- 14谁来打破IVD企业的IPO“魔咒”?
- 15注射剂过评企业“闷声发财”!49家药企围攻4个注射剂
 扫一扫关注医药之梯微信二维码
扫一扫关注医药之梯微信二维码
 个人登录
个人登录  企业登录
企业登录 
