CAR-T“致癌风险”警告,FDA宣布安全性审查
时间:2023/12/28来源:动脉网阅读:144
近日,金斯瑞公告称,公司旗下非全资附属公司传奇生物获美国FDA批准CARVYKTI的标签更新,以纳入CARTITUDE-1研究长期随访(中位持续时间为28个月)的额外疗效和安全性信息。
在本次标签更新中,美国处方信息的方框警告中添加了一项说明——在接受西达基奥仑赛治疗后,有患者发生了继发性血液系统恶性肿瘤,包括骨髓增生异常综合症和急性髓系白血病。
这项标签更新的数据是基于西达基奥仑赛的一项长期随访研究。金斯瑞公告显示,在CARTITUDE-1研究中,10%(10/97)的患者在接受西达基奥仑赛治疗后观察到了髓系肿瘤,包括骨髓增生异常综合征(MDS)、急性髓系白血病(AML),或是MDS后继发AML。
值得注意的是,所有含有整合载体的基因疗法产品,包括CAR-T疗法,都被标记为发展二次恶性肿瘤的潜在风险。
首款被FDA批准的国产CAR-T疗法
在中国CAR-T细胞疗法的发展史上,传奇生物是一个绕不开的名字。
CARVYKTI的中文名称为西达基奥仑赛,是首款被FDA批准的国产CAR-T疗法。在2022年3月,作为靶向BCMA的CAR-T疗法,西达基奥仑赛获批上市,用于治疗复发或难治性多发性骨髓瘤(R/R MM)患者,这些患者既往接受过四种或四种以上的治疗,包括蛋白酶体***、免疫调节剂和抗CD38单克隆抗体。
2022年12月,CARVYKTI在国内的上市申请获受理,适应症为用于复发/难治性多发性骨髓瘤患者的治疗。2023年1月,CARVYKTI被纳入优先审评审批程序。4月14日,公司与诺华签订协议,后者为其BCMA CAR-T疗法Carvykti提供生产服务,协议期限为三年。此前曾有媒体报道,传奇生物/强生宣布暂停在英国上市CARVYKTI,原因是CARVYKTI由于制造复杂导致供不应求。
在商业化能力方面,西达基奥仑赛在上市首年的总销售额为1.334亿美元(折合人民币约9.2亿元)。据金斯瑞半年报,截至今年上半年末,西达基奥仑赛的销售净额约1.17亿美元。
骨髓增生异常综合征是一类造血干细胞的疾病,表现为无效造血和难治性血细胞减少,临床患者表现差异较大,可大致分为低危、高危两类,高危时易向急性髓系白血病转换,因此也被认为是“白血病的前期”。而急性髓系白血病的发生,往往是患者骨髓、外周血或髓外组织中髓系原始细胞出现了恶性增殖,从而影响了正常血细胞的产生。该类疾病的分型较多,是一种较为凶险的血液系统恶性肿瘤。
从金斯瑞的公告中可见,患者在接受西达基奥仑赛治疗后,血液系统出现了比较棘手的状况,因此当前更新标签,以提请使用者评估和警示。在具体的病程方面,金斯瑞公告显示,患者接受西达基奥仑赛治疗后,髓系肿瘤发作的中位时间为485天(范围:162至1040天)。10名患者中,有9名在罹患骨髓肿瘤后死亡,有4例的发生时间是在后续抗骨髓瘤治疗开始后。
不过,金斯瑞的公告也提出,前述10名患者接受了多重既往治疗,其中一些患者在接受西达基奥仑赛治疗之前就存在基因突变;截至目前,西达基奥仑赛与髓系肿瘤发展之间的潜在机制尚未确定。
FDA开启CAR-T安全性调查
而此次传奇生物CARVYKTI的标签更新一事之所以引发关注,主要是由于11月28日美国FDA于官网宣布,收到CAR-T疗法引发恶性肿瘤的案例报告。
CARVYKTI是第一个在此次调查后更新标签的CAR-T产品,后续可能会有更多CAR-T细胞产品添加相应的黑框警告。同时也预示了一个信号,FDA对Car-T的监管是否会更严格。
根据公告,FDA收到了靶向BCMA或CD19的自体CAR-T细胞疗法应用中,存在患者出现T细胞恶性肿瘤(包括嵌合抗原受体CAR阳性淋巴瘤)的案例,来源包括临床试验及(或)产品上市后不良事件数据库。
FDA表示,在美国批准的BCMA和CD19靶向自体T细胞免疫疗法的处方信息中,发生继发性恶性肿瘤的潜在风险被标记为一类警告。这些产品批准后,需要进行15年的长期随访研究,以评估长期安全性和治疗后发生继发性恶性肿瘤的风险。接受这类疗法治疗的患者和临床试验参与者应终生监测新的恶性肿瘤情况,如若发生新的恶性肿瘤,应联系企业报告情况,并开展样本收集和检测研究。
同时,FDA于官网公开了目前已获批的六款疗法的具体名称,包括:百时美施贵宝的Abecma和Breyanzi,传奇生物和强生共同研发的Carvykti,诺华的Kymriah以及吉利德的Tecartus和Yescarta,靶向均为BCMA或CD19。
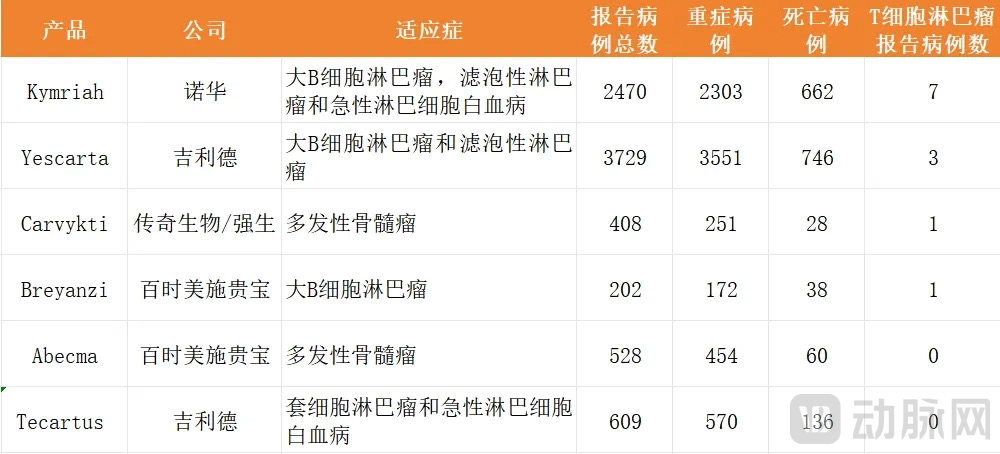
对于FDA的调查,这些公司也已经作出了回应。总结这些公司的观点就是,抗癌治疗中确实有继发性肿瘤产生的情况,但并无论证因果关系。
其中,传奇生物的Carvykti在美上市的适应症为多发性骨髓瘤,传奇生物曾表示,无论是否有CAR-T治疗,都会有继发性癌症的风险。同时,针对继发性癌症风险,现在全球市场上大约有2.5万病人使用过CAR-T产品,只有19例患者出现此情况,比例不算高。此外,从传奇生物自身来看,以前确有一例病例出现这种情况(引发T细胞恶性肿瘤),但是无法完全认为其与CAR-T产品有关,因为末线病人还会接受了化疗等一系列治疗。
事实上,CAR-T疗法作为一种新型抗肿瘤治疗方案,其安全性风险和病人获益评估问题一直备受关注。除了前文谈到的致癌风险,诸如细胞因子释放综合征(CRS)和神经毒性也是临床使用关注的问题。
CAR-T疗法代表了癌症治疗的一个新纪元,其在某些类型的癌症治疗中取得的显著成效不容忽视。然而,随着对这种治疗方法的深入研究和应用,其潜在的风险也逐渐显现。如今二次恶性肿瘤风险的可能性,更加深了对这一疗法安全性的关注。
但随着对CAR-T疗法长期影响的更深入了解,医学界正在发展更有效的监测和管理策略。例如,FDA要求进行15年的长期随访观察性安全研究,以评估治疗后长期安全性和二次恶性肿瘤的风险。
最新医药动态
更多»相关资讯
更多»- 1赛诺菲/再生元「度普利尤单抗」新适应症国内报上市
- 2国产首款!信达OX40L单抗IBI356启动临床
- 3大药企过去10年上市新药数目翻倍 是因为这一领域的突破?
- 4Grail即将被售卖?
- 5药事日报384期 | 重药控股董事辞职!强生终止与Bavarian Nordic这方面的合作
- 6国内首个!赛诺菲TNFR1抑制剂申报临床
- 7药事日报462期 | 翔宇医疗副总经理、董事会秘书辞职;德国PharmaLex在中国设立分公司,由原拜耳团队人员组建
- 8药事日报81期|国内首个新冠疫苗专利获批、赛诺菲36.8亿美元收购囊获BTK抑制剂产品组合
- 9药事日报289期 | 百济神州今日正式登陆科创板,开盘破发!
- 1039亿出让25%股份:老百姓的新并购战略与院外零售市场之战
- 11一年一度的ASCO年会公布(抗癌药研发成绩单)
- 12药事日报522期 | 康方生物拟再赴科创板上市!君实生物PD-1欧洲上市申请获EMA受理!
- 13关于公布第二批普通大输液议价结果的通知
- 14药事日报180期|辉瑞/Dewpoint共同开发DM1潜在疗法、BMS宣布Opdivo退出小细胞肺癌治疗领域
- 154+7药店集采还有多远?上海药店议价“三改”药品将受打击
 扫一扫关注医药之梯微信二维码
扫一扫关注医药之梯微信二维码
 个人登录
个人登录  企业登录
企业登录 
